题目内容
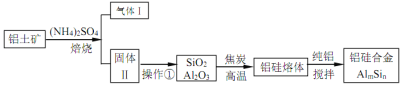
【题目】铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
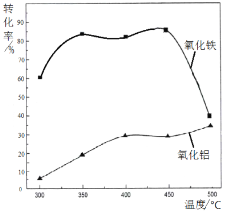
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
【答案】
(1)铁与铝形成原电池,加快了铝的腐蚀
(2)4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃
(3)Al3++4OH- = AlO2-+2H2O 或Al3++4OH- = Al(OH)4-
(4)![]()
(5)2.5×104
【解析】
试题分析:铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,在加纯铝搅拌,得到硅铝合金;
(1)Al、Fe形成原电池,Al活泼性比Fe强的做负极,被腐蚀,所以铝硅合金材料中若含铁,容易发生电化学腐蚀;故答案为:铁与铝形成原电池,加快了铝的腐蚀;
(2)根据题意,焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,反应的方程式为4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为350℃;故答案为:4(NH4)2SO4 + Fe2O3
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在350℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为350℃;故答案为:4(NH4)2SO4 + Fe2O3![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃;
2NH4Fe(SO4)2 + 3H2O + 6NH3↑;350℃;
(3)溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(4)在高温条件下,SiC与Al2O3反应生成Al、Si和CO,其反应的方程式为:3SiC+Al2O3![]() 3Si+2Al+3CO↑;转移18个电子,故答案为:
3Si+2Al+3CO↑;转移18个电子,故答案为:![]() ;
;
(5)当两种沉淀共存时,由于Ksp[Al(OH)3]=c(Al3+)c3(OH-),Ksp[Fe(OH)3]=c(Fe3+)c3(OH-),所以c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=2.5×104,故答案为:2.5×104。