题目内容
【题目】实验室用下列方法测定某水样中O2的含量。
(1)实验原理
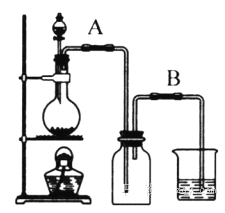
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,再用I-将生成的MnO(OH)2再还原为Mn2+,第二步反应的离子方程式为___________________。然后用Na2S2O3标准溶液滴定生成的I2。
已知:①2Mn2++O2+4OH-=2 MnO(OH)2 ②I2+2Na2S2O3=2NaI+Na2S4O6。
③S2O32-+2H+=SO2↑+S+H2O
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是______________;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液使溶液接近中性;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴________________作指示剂;
⑧用0.005 mol`L-1Na2S2O3滴定至终点。
(3)数据分析
①若在滴定过程中消耗的Na2S2O3标准溶液体积为3.60 mL,则此水样中氧气(O2)的含量为___(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将____________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________________。
【答案】 MnO(OH)2+2I-+4H+=2Mn2++I2+3H2O 赶走装置内空气,避免空气中的O2的干扰 淀粉溶液 7.2mg·L-1 偏大 若碱过量,则MnO(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应
【解析】(1)用I-将生成的MnO(OH)2再还原为Mn2+,锰元素化合价降低,则碘元素的化合价升高,根据化合价升降守恒配平,故答案为:2MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉溶液作指示剂;
故答案为:赶走装置内空气,避免空气中的O2的干扰;淀粉溶液;
(3)①根据已知的反应方程式可知氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,20mL水样中n(O2)= ![]() n(Na2S2O3)=
n(Na2S2O3)= ![]() ×0.005mol/L×(3.6×10-3L)=4.5×10-6mol,O2的质量为:4.5×10-6mol×32g/mol=1.44×10-4mg。则1L水样中O2的含量为1.44×10-4mg×
×0.005mol/L×(3.6×10-3L)=4.5×10-6mol,O2的质量为:4.5×10-6mol×32g/mol=1.44×10-4mg。则1L水样中O2的含量为1.44×10-4mg×![]() =7.2mg,故此水样中氧气(O2)的含量为7.2mg·L-1;
=7.2mg,故此水样中氧气(O2)的含量为7.2mg·L-1;
故答案为:7.2mg·L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大;故答案为:偏大;
③由于加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液体积偏大。
故答案为:若碱过量,则MnO(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1℃时,反应的平衡常数K=4.5
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T1
【题目】某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究. 【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2 .
序号 | V(H2SO4)/mL | c(H2SO4)/molL﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 3 | t2 |
检查该装置气密性的方法是 .
比较实验I和Ⅱ可以得出的结论是 .
【实验二】探究铁的电化学腐蚀.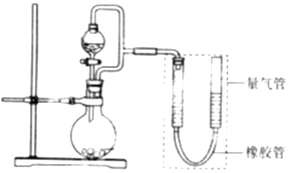
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面右侧液面(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是: . 实际观察到的现象可能与预测并不一致,装置气密性良好,原因是 .