题目内容
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
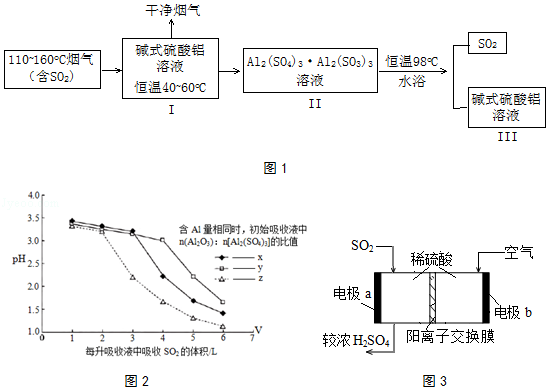
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
【答案】
(1)7;FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+
(2)增大;CuFeS2﹣4e﹣=Cu2++Fe2++2S;Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
(3)>;升高温度
【解析】解:(1)①a反应原理是硫化亚铁中的硫离子被氧化生成硫酸根,化合价变化为:+6﹣(﹣1)=7,即每有1molFeSO4生成转移移电子的物质的量为7mol,所以答案是:7;②d反应原理是硫化亚铁与铁离子反应,铁离子被还原生成亚铁离子,硫离子被氧化为硫酸根,离子反应方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+ , 所以答案是:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+;(2)①Ⅰ.FeS2周边即正极为氧气放电,氧气得到电子,结合溶液中的H+离子生成水,故溶液中氢离子浓度减小,pH值增大,所以答案是:增大; Ⅱ.负极黄铁矿中的硫失去电子,发生氧化反应生成硫单质,电极反应方程式为:CuFeS2﹣4e﹣=Cu2++Fe2++2S,所以答案是:CuFeS2﹣4e﹣=Cu2++Fe2++2S;②火法冶铜时,Cu2S与氧气反应生成铜和二氧化硫,方程式为:Cu2S+O2 ![]() 2Cu+SO2;所以答案是:Cu2S+O2
2Cu+SO2;所以答案是:Cu2S+O2 ![]() 2Cu+SO2;(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应,故△H>0,所以答案是:>;②由图可知:此反应为吸热反应,故升高温度,可以使反应向正向移动,即硫的脱除率越高,所以答案是:升高温度.
2Cu+SO2;(3)①由图可知,温度越高,K值越大,说明此反应为吸热反应,故△H>0,所以答案是:>;②由图可知:此反应为吸热反应,故升高温度,可以使反应向正向移动,即硫的脱除率越高,所以答案是:升高温度.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.