题目内容
【题目】某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )
A.
B.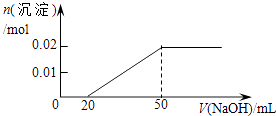
C.
D.
【答案】C
【解析】解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH﹣═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH﹣═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH﹣═AlO2﹣+2H2O,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝 会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.

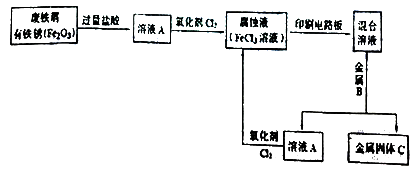
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
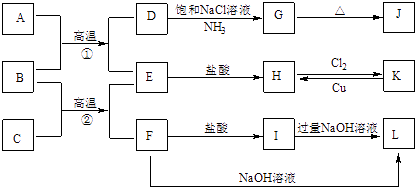
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).