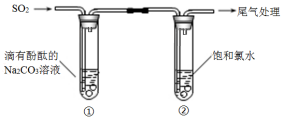
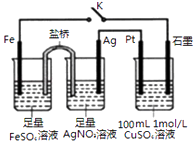
题目内容
【题目】硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂.
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有性.
(2)①在100mL 18molL﹣1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44L,则参加反应的铜片的质量为(选填序号);
a.115.2g b.76.8g c.57.6g d.38.4g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: .
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: .
【答案】
(1)强氧化;不稳定;挥发
(2)d;3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
(3)2Cl﹣﹣2e﹣=Cl2↑
【解析】解:(1)浓硫酸具有强氧化性,可使铝钝化,则常温下可用铝槽车装运浓硫酸;浓硝酸不稳定,易分解,应保存在棕色试剂瓶中;盐酸易挥发,敞口放置的浓盐酸浓度会减小,所以答案是:强氧化;不稳定;挥发;(2)①铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O,n(SO2)=
CuSO4+SO2↑+H2O,n(SO2)= ![]() =0.6mol,则由方程式可知消耗的铜的质量为0.6mol×64g/mol=38.4g,所以答案是:d;②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸,稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;(3)电解时,阳极发生氧化反应,生成氯气,电极方程式为2Cl﹣﹣2e﹣=Cl2↑,所以答案是:2Cl﹣﹣2e﹣=Cl2↑.
=0.6mol,则由方程式可知消耗的铜的质量为0.6mol×64g/mol=38.4g,所以答案是:d;②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸,稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;(3)电解时,阳极发生氧化反应,生成氯气,电极方程式为2Cl﹣﹣2e﹣=Cl2↑,所以答案是:2Cl﹣﹣2e﹣=Cl2↑.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).