题目内容
【题目】热电厂用碱式硫酸铝[Al2(SO4)3Al2O3]吸收烟气中低浓度的二氧化硫.具体过程如下:
(1)碱式硫酸铝溶液的制备 往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝(络合物,易溶于水),同时析出生石膏沉淀[CaSO42H2O],反应的化学方程式为 .
(2)SO2的吸收与解吸.吸收液中碱式硫酸铝活性组分Al2O3对SO2具有强大亲和力,化学反应为:Al2(SO4)3Al2O3(aq)+3SO2(g)Al2(SO4)3Al2(SO3)3(aq)△H<0.工业流程如图1所示: 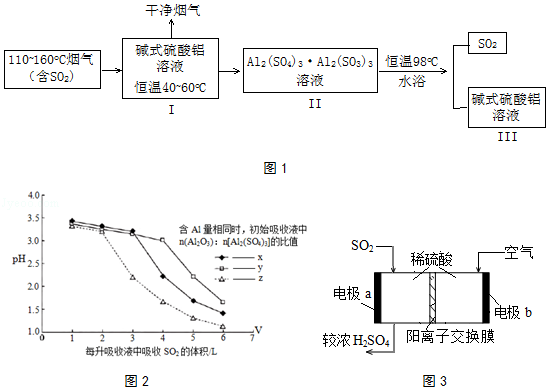
①高温烟气可使脱硫液温度升高,不利于SO2的吸收.生产中常控制脱硫液在恒温40~60oC,试分析原因 .
②研究发现,I中含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合.其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定不同参数的吸收液的pH变化,结果如2图所示:
据此判断初始阶段,SO2的结合方式是 . 比较x、y、z的大小顺序 .
③III中得到再生的碱式硫酸铝溶液,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降,请用化学方程式加以解释: .
(3)解吸得到较纯的SO2 , 可用于原电池法生产硫酸如图3. ①电极b周围溶液pH(填“变大”、“变小”或“不变”)
②电极a的电极反应式是 .
【答案】
(1)2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3?Al2O3+3CaSO4?2H2O
(2)碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收;与活性Al2O3结合;y>x>z;2Al2(SO3)3+3O2=2Al2(SO4)3或2[Al2(SO4)3?Al2(SO3)3]+3O2=4Al2(SO4)3
(3)变大;SO2﹣2e﹣+2H2O=4H++SO42﹣
【解析】解:(1)往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝Al2(SO4)3Al2O3 , 同时析出生石膏沉淀[CaSO42H2O],化学方程式为:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3Al2O3+3CaSO42H2O; 所以答案是:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3Al2O3+3CaSO42H2O;(2)①碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收,生产中常控制脱硫液在恒温40~60oC;所以答案是:碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收;②由图2可知,碱式硫酸铝中的活性Al2O3含量不同时,酸度计测定不同参数的吸收液的pH有变化,说明SO2的结合方式是与活性Al2O3结合,pH相同时,活性Al2O3吸收越多SO2 , 则y>x>z;所以答案是:与活性Al2O3结合;y>x>z;③Al2(SO4)3Al2(SO3)3溶液恒温98℃,溶液分解得到III中得到再生的碱式硫酸铝溶液,分解过程中部分Al2(SO3)3被氧化为Al2(SO4)3 , 2Al2(SO3)3+3O2=2Al2(SO4)3或2[Al2(SO4)3Al2(SO3)3]+3O2=4Al2(SO4)3 , 其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降;所以答案是:2Al2(SO3)3+3O2=2Al2(SO4)3或2[Al2(SO4)3Al2(SO3)3]+3O2=4Al2(SO4)3;(3)①电极b为空气中氧气放电结合氢离子的反应,氢离子浓度减小,pH增大;所以答案是:变大;②电极a为二氧化硫放电失电子发生的氧化反应,电极反应式为:SO2﹣2e﹣+2H2O=4H++SO42﹣;所以答案是:SO2﹣2e﹣+2H2O=4H++SO42﹣ .

【题目】某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究. Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/molL﹣1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
(1)由上述资料2可得出的正确结论是(选填下列字母编号) a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15molL﹣1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16molL﹣1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为 .
(3)Ⅱ.产物性质探究 Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3 , Cu(OH)2 , 或者CuCO3与Cu(OH)2的混合物.
1)若沉淀是Cu(OH)2 , 生成沉淀的离子方程式是 .
2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1 , K3 , 关闭K2 , K4 , 通入足量空气
c.关闭K1 , K3 , 打开K2 , K4 , 充分反应
d.反应结束后,关闭K2 , 打开K1 , 再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为 , 若不进行步骤d,则会使测得Cu(OH)2的质量分数为(填“偏高”“无影响”“偏低”)
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. 
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步: ①a反应中每生成1molFeSO4转移电子的物质的量为mol.
②d反应的离子方程式为 .
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示: ①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
相关反应 | 反应热 | 平衡常数 |
FeS2(s)+H2(g)FeS(s)+H2S(g) | △H1 | K1 |
| △H2 | K2 |
FeS(s)+H2(g)Fe(s)+H2S(g) | △H3 | K3 |
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
