题目内容
【题目】汽车尾气是产生雾霾的主要因素,对废气的综合治理是当前“打赢蓝天保卫战”的重要举措。

(1)利用某些催化剂,可实现将空气中的碳氧化物和氮氧化物转化为无毒的大气可循环物质。
已知:①N2(g)+O2(g)2NO(g)△H1=+180.5kJmol-1
②2C(s)+O2(g)2CO(g)△H2=-221.0kJmol-1
③C(s)+O2(g)CO2(g)△H3=-393.5kJmol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=______kJmol-1;某温度下,反应①、②、③的平衡常数分别为K1、K2、K3表示,则该反应的平衡常数K=______(用K1、K2、K3表示)。
(2)在同温同压下,一定量的NO和CO在不同催化剂条件下反应的能量变化如图所示。当反应进行相同的时间时,测得催化剂______(填“1”或“2”)条件下NO转化率更高,其原因是______。

(3)一定温度下,向体积为1L的密闭容器中充入NO和CO的混合气体2mol,在催化剂作用下发生反应2NO(g)+2CO(g)N2(g)+2CO2(g),达到平衡时,NO、CO的转化率及N2的体积分数为![]() 的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。

(4)利用如图所示的电解装置能将NO变废为宝,其中a、b为惰性电极。电极a的电极反应式为______。每转移3mol电子,溶液中通过质子交换膜的离子的物质的量是______mol。

【答案】-746.5 ![]() 2 催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高 b 160 NO-3e-+2H2O=4H++NO3- 3
2 催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高 b 160 NO-3e-+2H2O=4H++NO3- 3
【解析】
(1)利用盖斯定律完成;通过平衡常数的表达式得出K;
(2)从催化剂可以加快反应速率角度进行分析;
(3)根据横坐标代表![]() ,随着数值的增大,可以认为是增大n(NO),则NO的转化率降低,据此分析;利用三段式法计算出平衡常数;
,随着数值的增大,可以认为是增大n(NO),则NO的转化率降低,据此分析;利用三段式法计算出平衡常数;
(4)电极b产生H2,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上发生氧化反应,化合价升高,写出电极反应式即可,电路中通过的电量相等,从而判断出通过交换膜的离子的物质的量;
(1)利用目标反应方程式以及盖斯定律,③×2-①-②,得出△H=[(-393.5)×2+221.0-180. 5]kJ·mol-1=-746.5kJ·mol-1;①K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ,K=
,K=![]() ,K=
,K=![]() ;
;
(2)催化剂催化效率越高,相同时间内NO转化率越高,根据图像,催化剂2条件下活化能更低,反应速率更快,因此在相同时间NO转化率更高;
(3)横坐标代表![]() ,随着数值的增大,可以认为是提高n(NO),n(CO)不变,即NO的转化率降低,根据图像,曲线b表示NO的转化率;NO和CO的混合气体为2mol,
,随着数值的增大,可以认为是提高n(NO),n(CO)不变,即NO的转化率降低,根据图像,曲线b表示NO的转化率;NO和CO的混合气体为2mol,![]() =1,则n(NO)=n(CO)=1mol,此时NO的转化率为80%,
=1,则n(NO)=n(CO)=1mol,此时NO的转化率为80%, ,K=
,K=![]() =
=![]() =160;
=160;
(4) 电极b产生H2,电极反应式为2H++2e-=H2↑,电极b为阴极,电极a为阳极,阳极上发生氧化反应,化合价升高,NO→HNO3,即电极反应式为NO-3e-+2H2O=4H++NO3-;质子交换膜只允许H+通过,通过电量相同,因此通过质子交换膜的H+物质的量为3mol。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
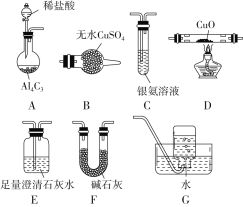
(查阅资料)
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3;
②Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为__________________________。
(2)按气流方向各装置从左到右的连接顺序为A→_____________________。
(3)实验中滴加稀盐酸的操作是_________________________。
(4)已知气体产物中含有CO,则装置C中可能观察到的现象是___________________________;装置F的作用为____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______;
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量的0.1 mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需要增加对比实验,完成表中内容。
实验步骤(不要求写出具体的操作过程) | 预期现象与结论 |
________________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu |