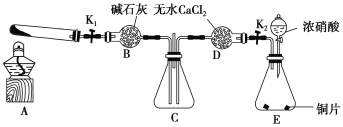
题目内容
【题目】25℃时,体积均为25. 00 mL,浓度均为0.0100 mol/L的HA、H3B溶液分别用0.0100mol/L NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是

A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0. 0100 mol/L HA、H3B溶液中,酸性较强的是HA
C.25℃时,0. 0100 mol/L Na2HB溶液的pH >7
D.25℃时,向Na2HB溶液中滴加HA溶液反应的离子方程式为:HB2- + HA == H2B- + A-
【答案】CD
【解析】
A.0.0100 mol/L的HA溶液如果为强酸,氢离子浓度为0.0100 mol/L,pH=2,由图可知起始HA溶液的pH在3~4之间,说明HA为一元弱酸,滴定终点生成强碱弱酸盐,溶液呈碱性,而甲基橙的变色范围是3.1~4.4,所以应选酚酞作指示剂,故A错误;
B.由图可知,浓度均为0.0100 mol/L的HA、H3B溶液,H3B溶液起始时pH更小,说明H3B电离出氢离子的能力强于HA,则酸性较强的为H3B,故B错误;
C. HB2-+H2O H2B-+OH-,Kh=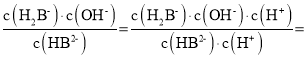
![]() ,由图可知
,由图可知![]() 时,pH为7.2,则Ka2=10-7.2,Kh=10-6.8,即常温下HB2-的水解程度大于电离程度,Na2HB溶液呈碱性,故C正确;
时,pH为7.2,则Ka2=10-7.2,Kh=10-6.8,即常温下HB2-的水解程度大于电离程度,Na2HB溶液呈碱性,故C正确;
D.由图可知![]() 时,pH为4.75,
时,pH为4.75,![]() 时,pH为7.2,HA溶液的酸性强于Na2HB溶液,向Na2HB溶液中滴加HA溶液符合强酸制弱酸,离子方程式为:HB2-+ HA=H2B-+ A-,故D正确;
时,pH为7.2,HA溶液的酸性强于Na2HB溶液,向Na2HB溶液中滴加HA溶液符合强酸制弱酸,离子方程式为:HB2-+ HA=H2B-+ A-,故D正确;
答案选CD。

练习册系列答案
相关题目