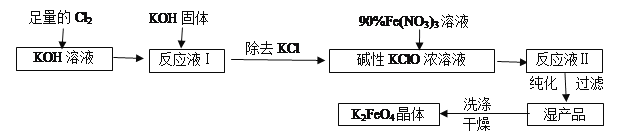
题目内容
【题目】某温度下,向一定体积0.1 mol·L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示。 下列说法错误的是

A. 此温度下,水的离子积常数为1.0×10-2a
B. M、N两点所示的溶液中,水的电离程度相同
C. Q点消耗的NaOH溶液的体积等于HA溶液的体积
D. N点溶液加水稀释,![]() 减小
减小
【答案】C
【解析】A.Q点时pOH=pH,说明c(OH-)=c(H+)=l0-amol/L,水的离子积Kw=c(OH-)×c(H+)=1.0×l0-2a,故A正确;B.由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故B正确;C.恰好反应得到NaA溶液呈碱性,Q点的pH=pOH,溶液呈中性,HA稍过量,则Q点消耗的NaOH的体积小于HA的体积,故C错误;D.N点溶液加水稀释,Ka=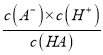 ,温度不变,Ka不变,加水稀释氢氧根离子浓度减小,c(H+)增大,所以
,温度不变,Ka不变,加水稀释氢氧根离子浓度减小,c(H+)增大,所以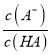 变小,故D正确;故选C。
变小,故D正确;故选C。

【题目】氧化还原滴定实验与中和滴定实验类似,现用0.1000mol/L的酸性高锰酸钾溶液滴定未
知浓度的无色亚硫酸氢钠溶液,回答下列问题:
(1)滴定前润洗滴定管的操作方法__________。
(2)某同学测得的实验数据如下表
1 | 2 | 3 | 4 | |
亚硫酸氢钠溶液体积mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初体积mL | 0.00 | 1.02 | 1.00 | 0.80 |
滴定管末体积mL | 40.02 | 41.00 | 41.00 | 42.90 |
求待测液亚硫酸氢钠的物质的量浓度________。
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,则计算值比实际值___(填“偏高”或“偏低”或“不变”) 。
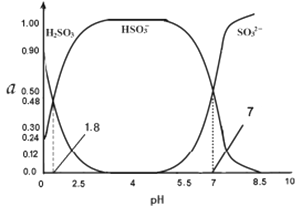
(4)常温下0.1000mol/L亚硫酸溶液中H2SO3 HSO3- SO32-三者所占物质的量分数(a)随pH变化的关系如图所示,已知lg2=0.3,则原亚硫酸氢钠溶液的pH=_______:
(5)取上述亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,(假定加固体后溶液的体积不变),则该溶液能溶解硫酸钡的物质的量n=______(已知该温度时KSp(BaSO4)=1.0×10-10 KSp(BaSO3)=1.0×10-8 )。
【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
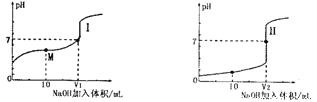
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。