题目内容
【题目】氧化还原滴定实验与中和滴定实验类似,现用0.1000mol/L的酸性高锰酸钾溶液滴定未
知浓度的无色亚硫酸氢钠溶液,回答下列问题:
(1)滴定前润洗滴定管的操作方法__________。
(2)某同学测得的实验数据如下表
1 | 2 | 3 | 4 | |
亚硫酸氢钠溶液体积mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初体积mL | 0.00 | 1.02 | 1.00 | 0.80 |
滴定管末体积mL | 40.02 | 41.00 | 41.00 | 42.90 |
求待测液亚硫酸氢钠的物质的量浓度________。
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,则计算值比实际值___(填“偏高”或“偏低”或“不变”) 。
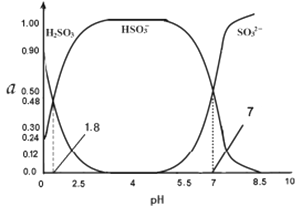
(4)常温下0.1000mol/L亚硫酸溶液中H2SO3 HSO3- SO32-三者所占物质的量分数(a)随pH变化的关系如图所示,已知lg2=0.3,则原亚硫酸氢钠溶液的pH=_______:
(5)取上述亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,(假定加固体后溶液的体积不变),则该溶液能溶解硫酸钡的物质的量n=______(已知该温度时KSp(BaSO4)=1.0×10-10 KSp(BaSO3)=1.0×10-8 )。
【答案】 从滴定管上口加入少量标准液(或待测液),倾斜着转动滴定管,使液体湿润内壁,然后从下部放出,重复2-3次 0.400mol/L 偏高 3.7 4×10-3
【解析】(1)滴定前润洗滴定管的操作为从滴定管上口加入少量标准液(或待测液),倾斜着转动滴定管,使液体湿润内壁,然后从下部放出,重复2-3次,故答案为:从滴定管上口加入少量标准液(或待测液),倾斜着转动滴定管,使液体湿润内壁,然后从下部放出,重复2-3次;
(2)滴定过程的方程式为6H++2MnO4-+5SO32-=2Mn2++5SO42-+3H2O,四次滴定消耗的高锰酸钾的体积分别为:40.02、39.98、40.00、42.10,很明显,第四次的滴定误差较大,删除,三次滴定消耗高锰酸钾溶液的体积平均为![]() =40.00mL,待测液中亚硫酸氢钠的物质的量浓度=
=40.00mL,待测液中亚硫酸氢钠的物质的量浓度=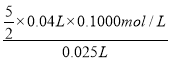 = 0.400mol/L,故答案为:0.400mol/L;
= 0.400mol/L,故答案为:0.400mol/L;
(3)滴定前平视高锰酸钾液面,达滴定终点后仰视液面,导致高锰酸钾溶液的体积偏大,则计算值比实际值偏高,故答案为:偏高;
(4)原亚硫酸氢钠的物质的量浓度= 0.400mol/L,HSO3-H++SO32-,根据图像可知,pH=7时,亚硫酸根离子与亚硫酸氢根离子浓度相等,则Ka2=10-7,则c2(H+)=0.4×10-7,解得c(H+)=![]() =2×10-4 mol/L,pH=4-0.3=3.7,故答案为:3.7;
=2×10-4 mol/L,pH=4-0.3=3.7,故答案为:3.7;
(5)取0.400mol/L亚硫酸氢钠溶液1L,先加入氢氧化钠固体,使溶液的pH=10,则反应后生成0.400mol/L的亚硫酸钠溶液,c(SO32-)=0.400mol/L,溶液中的c(Ba2+)=![]() =
=![]() =2.5×10-8,则c(SO42-)=
=2.5×10-8,则c(SO42-)=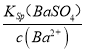 =
=![]() = 4×10-3,故答案为:4×10-3。
= 4×10-3,故答案为:4×10-3。

 阅读快车系列答案
阅读快车系列答案【题目】某校化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
牙膏品牌 | A儿童牙膏 | B防臭牙膏 | C透明牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)上述三种摩擦剂成分中属于酸性氧化物的是________(填化学式,下同);既能与强酸反应又能与强碱反应的是________。
(2)A儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是______________________________。
(3)从摩擦剂成分考虑,向B防臭牙膏样品中滴加少量稀盐酸,可观察到的现象是______________________________________,该反应的化学方程式为_______________________。
(4)C透明牙膏摩擦剂成分SiO2是工业制备晶体硅的原料,其反应原理是_______________(用化学反应方程式表示)。