题目内容
已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比改变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的 ( )。
A.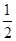 | B. | C.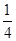 | D. |
C
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列过程中不涉及氧化还原反应的是( )
| A.用SO2漂白纸浆和草帽辫 |
| B.用氯化铁溶液腐蚀印刷线路板上的铜膜 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.高温下用焦炭还原SiO2制取粗硅 |
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
| A.解毒时美蓝表现氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒过程中血红蛋白显氧化性 |
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
将一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体 (标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是
| A.气体A为二氧化硫和氢气的混合物 |
| B.气体A中二氧化硫和氢气的体积比为4:1 |
| C.反应中共消耗锌95.5g |
| D.反应中共转移电子1.5mol |
将a g二氧化锰粉末加入b mol·L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.可以收集到氯气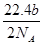 L L |
| B.反应后溶液中的Cl-数目为2aNA/87 |
C.NA可表示为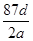 |
| D.反应后溶液中的H+数目为(bc-2d) |
古代曾用绿矾加强热得到硫酸、红色粉末和有刺激性气味的气体,此反应属于( )
| A.有氧化还原的分解反应 |
| B.无氧化还原的分解反应 |
| C.只是氧化还原反应 |
| D.只是分解反应 |
镁铝合金5.1 g完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量为( )
| A.13.6 g | B.7.8 g | C.5.8 g | D.4 g |
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O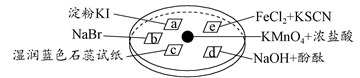
对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
ClO2是一种杀菌消毒效率高的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中不正确的是( )
| A.ClO2是还原产物 |
| B.1 mol KClO3参加反应,失去电子为1 mol |
| C.H2C2O4在反应中被氧化 |
| D.H2C2O4的还原性大于ClO2的还原性 |