题目内容
【题目】(Ⅰ)有以下10种物质:①液态氯化氢、②CCl4、③液氯、④硫酸铵晶体、⑤铁、⑥稀硫酸、⑦澄清石灰水、⑧二氧化硫,⑨熔融的硫酸钠、⑩Na2O固体。其中属于电解质的是_______(填序号,下同),属于非电解质的是_________,在现状态下能导电的是__________,写出④在水溶液中电离的方程式__________。
(Ⅱ)A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)C的离子结构示意图为_________;
(2)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_________。
【答案】①、④、⑨、⑩; ②、⑧ ⑤、⑥、⑦、⑨ (NH4)2SO4=2NH4++SO42- 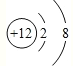 10
10
【解析】
水溶液或熔融状态下导电的化合物为电解质,都不导电的化合物为非电解质,根据定义分析。根据A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, A为硫,B为氧,C原子的质子数比A少4,为镁。据此解答。
(Ⅰ)水溶液或熔融状态下导电的化合物为电解质,都不导电的化合物为非电解质, 所以属于电解质的有①④⑨⑩;非电解质的有②⑧;电解质在水溶液或熔融状态下能导电,金属能导电,所以能导电的有⑤⑥⑦⑨,硫酸铵在水溶液中电离出铵根离子和硫酸根离子,电离方程式为:(NH4)2SO4=2NH4++SO42-;
(Ⅱ)A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3,A为硫,B为氧,C原子的质子数比A少4,为镁。 (1)镁离子结构示意图为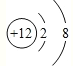 ;
;
(2) 硫元素的一种质量数为32的核素,该原子的相对分子质量为32,与氧的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,说明该离子的相对分子质量为104,则该氧原子的相对原子质量为(104-32)/4=18,则的中子数为18-8=10。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
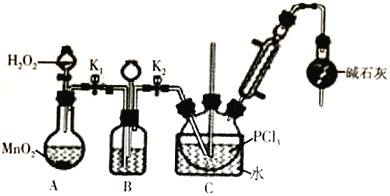
(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。
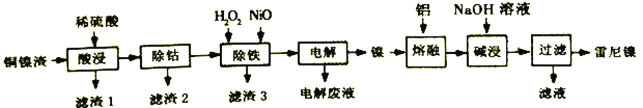
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。