��Ŀ����
���Ե�ؾ��������ŵ��������ص㣬����õ��㷺Ӧ�á�п-�̼��Ե��������������ҺΪ���Һ������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��=Zn��OH��2��s��+Mn2O3��s����������˵����ȷ���ǣ� ��
| A����ع���ʱ��MnO2������ԭ��Ӧ |
| B����ظ����ĵ缫��ӦʽΪ��2MnO2+H2O+2e-��Mn2O3+2OH- |
| C����ع���ʱ��K+���� |
| D����ع���ʱ����·��ÿͨ��0.1mol���ӣ�п�����������ϼ���6.5g |
A
�����������Ӧ��Zn���ϼ����ߣ�Mn���ϼ۽��͡�������Zn��ʧ���ӣ�����������Ӧ���缫��ӦʽΪ��Zn��2e-+2OH-=Zn(OH)2��������MnO2���õ��ӣ�������ԭ��Ӧ���缫��ӦΪMnO2+2e-+H2O=Mn2O3+2OH-��A��ȷ��B����ԭ����ڲ�������������Ǩ�ƣ���������Ǩ�ƣ�C������Zn��2e-+2OH-=Zn(OH)2֪ÿת��2mol��������п65g��D����
������ԭ����и����Ϸ���������Ӧ��ʧȥ���ӣ������Ϸ�����ԭ��Ӧ���õ����ӣ�ԭ����ڲ�������������Ǩ�ƣ���������Ǩ�ơ�

��ϰ��ϵ�д�
 ���ݼ���ϵ�д�
���ݼ���ϵ�д�
�����Ŀ
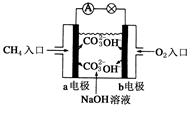
 ��2e��===H2O��CO2���õ�طŵ�ʱ������˵������ȷ����(����)
��2e��===H2O��CO2���õ�طŵ�ʱ������˵������ȷ����(����)