题目内容
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
写出插入烧碱溶液中形成原电池的负极反应式: 。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
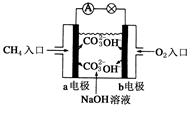
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
| A.铝片、铜片 | B.铜片、铝片 | C.铝片、铝片 | D.铜片、铜片 |
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
(16分)
(1) Pb+SO42-–2e-=PbSO4(2分) PbO2+SO42-+4H++2e-=PbSO4+2H2O(2分)
(2) 2Fe3++Cu=2Fe2++Cu2+(2分) Cu(1分) Fe3++e-=Fe 2+(2分)
(3) B(1分),Al+4OH-–3e-=AlO2-+2H2O(2分)
(4)① a(1分),CH4+10OH-–8e-=CO32++7H2O(2分) ②减小(1分)
(1) Pb+SO42-–2e-=PbSO4(2分) PbO2+SO42-+4H++2e-=PbSO4+2H2O(2分)
(2) 2Fe3++Cu=2Fe2++Cu2+(2分) Cu(1分) Fe3++e-=Fe 2+(2分)
(3) B(1分),Al+4OH-–3e-=AlO2-+2H2O(2分)
(4)① a(1分),CH4+10OH-–8e-=CO32++7H2O(2分) ②减小(1分)
试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以根据总的反应式可知,Pb是负极,失去电子,二氧化铅是正极得到电子,因此电极反应式分别是,负极:Pb+SO42-–2e-=PbSO4,正极:PbO2+SO42-+4H++2e-=PbSO4+2H2O。
(2)氯化铁和铜反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+,所以如果要将该反应设计成原电池,则负极应该是铜,正极是铁离子得到电子,则正极反应式为Fe3++e-=Fe 2+。
(3)铝在浓硝酸中发生钝化,所以此时铝是正极,铜是负极。而在氢氧化钠溶液中,铜和氢氧化钠不反应,所以铝是负极,铜是正极,答案选B。其中插入烧碱溶液中形成原电池的负极反应式Al+4OH-–3e-=AlO2-+2H2O。
(4)①甲烷失去电子,所以在负极通入,因此电池的负极是a。由于电解质是氢氧化钠溶液,所以电极反应式是CH4+10OH-–8e-=CO32++7H2O。
②由于反应中有碳酸钠生成,消耗氢氧化钠,所以电池工作一段时间后电解质溶液的pH减小。
点评:该题是高考中的常见题型,属于中等难度的试题。试题注重基础,难易适中,侧重对学生基础知识的巩固与训练,有利于培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理,并能结合题意具体问题、具体分析即可。

练习册系列答案
相关题目
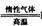 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2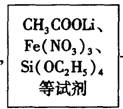
 Li2FeSiO4
Li2FeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;