题目内容
(10分)短周期元素W、X、Y和Z的原子序数依次增大。金属元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。
(1)W元素的原子核外共有________ 种不同运动状态的电子、_______ 种不同能量的电子。
(2)元素Z与元素X形成共价化合物XZ2是________(选填“极性”或“非极性”)分子,其电子式为 ________________。
(3)Y原子的最外层电子排布式为________________,Y元素最高价氧化物对应的水化物的电离方程式为 ________________________________________________。
(4)两种非金属元素中,非金属性较强的元素是_______(写元素符号),试写出一个能说明这一事实的化学方程式________________________________________________。
(1)W元素的原子核外共有________ 种不同运动状态的电子、_______ 种不同能量的电子。
(2)元素Z与元素X形成共价化合物XZ2是________(选填“极性”或“非极性”)分子,其电子式为 ________________。
(3)Y原子的最外层电子排布式为________________,Y元素最高价氧化物对应的水化物的电离方程式为 ________________________________________________。
(4)两种非金属元素中,非金属性较强的元素是_______(写元素符号),试写出一个能说明这一事实的化学方程式________________________________________________。
(1) 3,2 (2)非极性,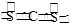
(3)3s23p1,H2O+H++AlO2- Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
(4)S,H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
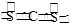
(3)3s23p1,H2O+H++AlO2-
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH- (4)S,H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
:
试题分析:X原子最外层电子数是内层电子数的2倍可知X为C,地壳中含量最丰富的金属元素是Al(Y),Z最外层电子数是电子层数的2倍可知Z为S,由四种元素原子序数依次增大且W是制造高效电池的材料可知W为Li。
(1)没有运动状态完全相同的电子,Li原子序数为3,电子数也为3,所以W原子核外有3种不同运动状态的电子,Li核外电子排布式为1s22s1,所以有两种不同能量的电子。
(2)CS2是非极性分子,电子式为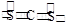 。
。
(3)Al最外层电子排布式为3s23p1,Al最高价氧化物对应水化物为氢氧化铝,电离方程式为H2O+H++AlO2- Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。
(4)最高价氧化物对应水化物酸性与元素非金属性一致,S、C对应的最高价氧化物对应水化物分别为H2SO4和H2CO3,硫酸是强酸,碳酸是弱酸,所以非金属性S>C,可以用硫酸制取碳酸证明,方程式为H2SO4+Na2CO3=Na2SO4+H2O+CO2↑。
非金属性强弱比较
点评:本题将元素推断与物质结构与性质联系考查,增加了难度。
试题分析:X原子最外层电子数是内层电子数的2倍可知X为C,地壳中含量最丰富的金属元素是Al(Y),Z最外层电子数是电子层数的2倍可知Z为S,由四种元素原子序数依次增大且W是制造高效电池的材料可知W为Li。
(1)没有运动状态完全相同的电子,Li原子序数为3,电子数也为3,所以W原子核外有3种不同运动状态的电子,Li核外电子排布式为1s22s1,所以有两种不同能量的电子。
(2)CS2是非极性分子,电子式为
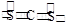 。
。(3)Al最外层电子排布式为3s23p1,Al最高价氧化物对应水化物为氢氧化铝,电离方程式为H2O+H++AlO2-
 Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。(4)最高价氧化物对应水化物酸性与元素非金属性一致,S、C对应的最高价氧化物对应水化物分别为H2SO4和H2CO3,硫酸是强酸,碳酸是弱酸,所以非金属性S>C,可以用硫酸制取碳酸证明,方程式为H2SO4+Na2CO3=Na2SO4+H2O+CO2↑。
非金属性强弱比较
点评:本题将元素推断与物质结构与性质联系考查,增加了难度。

练习册系列答案
相关题目


 __________________。
__________________。