题目内容
9.五种短周期元素A、B、C、D、E在元素周期表中相对位置如图所示,其中E形成的两种氧化物都是大气污染物且E的单质是一种黄色晶体.| A | B | ||
| C | D | E |
(2)B的气态氢化物与其最高价氧化物对应水化物可形成盐,其盐溶液显酸性(填“酸性”、“中性”或“碱性”)用离子方程式表示其原因:NH4++H2O?NH3.H2O+H+.
(3)写出C元素原子的价电子排布式:3s23p1比较B、E元素基态原子的第一电离能大小N>S(用元素符号填空).
(4)A与氢元素形成最简单化合物H可作为燃料电池的原料,写出该燃料电池(以足量NaOH溶液作为电解质溶液)负极电极反应CH4+10 OH--8e-=CO32-+7H2O已知25℃/101kPa下,H的燃烧热为890kJ•mol-1,写出H燃烧热的化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1.
(5)向150ml.0.10•L-1的氯化物溶液中加入40mLNaOH溶掖,充分反应后得到0.78g沉淀.则原NaOH溶液的物质的量浓度可能是0.75或1.5mol•L-1.
分析 短周期元素中,E元素形成的两种氧化物都是大气污染物且E的单质是一种黄色晶体,则E为S元素;由在元素周期表中相对位置,可知A为C元素、B为N元素、C为Al、D为Si.
(1)非金属性越强,氢化物越稳定,最高价含氧酸的酸性越强;
(2)B的气态氢化物与其最高价氧化物对应水化物形成的盐为NH4NO3,其盐溶液中NH4+离子水解,溶液呈酸性;
(3)Al元素处于第三周期IIIA族;同主族自上而下元素第一电离能减小,N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(4)A与氢元素形成最简单化合物H为CH4,原电池负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,CH4燃烧热的化学方程式中,甲烷化学计量数为1,注明物质聚集状态与反应热书写热化学方程式;
(5)AlCl3的物质的量=0.15L×0.1mol/L=0.015mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3为0.015mol,而实际得到 Al(OH)3沉淀为$\frac{0.78g}{78g/mol}$=0.01mol<0.015mol,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O可知,NaOH存在两种情况,一是NaOH不足,部分Al3+转化为Al(OH)3,二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,以此计算.
解答 解:短周期元素中,E元素形成的两种氧化物都是大气污染物且E的单质是一种黄色晶体,则E为S元素;由在元素周期表中相对位置,可知A为C元素、B为N元素、C为Al、D为Si.
(1)由于非金属性C>Si,故氢化物稳定性CH4>SiH4,由于非金属性S>Si,故最高价氧化物对应水化物的酸性:H2SO4>H2SiO3,
故答案为:CH4;SiH4;H2SO4;H2SiO3;
(2)B的气态氢化物与其最高价氧化物对应水化物形成的盐为NH4NO3,其盐溶液中NH4+离子水解:NH4++H2O?NH3.H2O+H+,溶液显酸性,
故答案为:酸性;NH4++H2O?NH3.H2O+H+;
(3)Al元素原子的价电子排布式:3s23p1,同主族自上而下元素第一电离能减小,N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>S,故答案为:3s23p1;N>S;
(4)A与氢元素形成最简单化合物H为CH4,原电池负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4+10 OH--8e-=CO32-+7H2O,
已知25℃/101kPa下,CH4的燃烧热为890kJ•mol-1,CH4燃烧热的化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1,
故答案为:CH4+10 OH--8e-=CO32-+7H2O;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1;
(5)AlCl3的物质的量=0.15L×0.1mol/L=0.015mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3为0.015mol,而实际得到 Al(OH)3沉淀为$\frac{0.78g}{78g/mol}$=0.01mol<0.015mol,则:
一是NaOH不足,部分Al3+转化为Al(OH)3,则:
Al3++3OH-=Al(OH)3↓
0.03mol 0.01mol
故氢氧化钠溶液的物质的量浓度为$\frac{0.03mol}{0.04L}$=0.75mol/L;
二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,则:
Al3++3OH-=Al(OH)3↓
0.015mol 0.045mol 0.015mol
Al(OH)3+OH-=AlO2-+2H2O,
(0.015-0.01)mol 0.005mol
故氢氧化钠溶液的物质的量浓度为$\frac{0.045mol+0.005mol}{0.04L}$=1.5mol/L,
故答案为:0.75或1.5.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、电离能、电极反应式书写、热化学方程式书写、化学计算等,(5)中计算关键是判断发生的反应,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | n=m+15 | B. | n=m+5 | C. | n=m+29 | D. | n=m+9 |
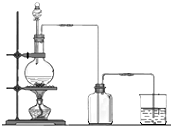 实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答:
实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答: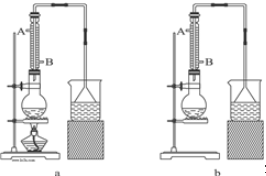 (2)冷凝管中的冷凝水的流向应是B
(2)冷凝管中的冷凝水的流向应是B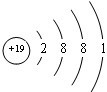
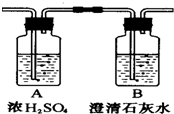 燃烧法是测定有机化合物化学式的一种重要方法.
燃烧法是测定有机化合物化学式的一种重要方法.