题目内容
19. 燃烧法是测定有机化合物化学式的一种重要方法.
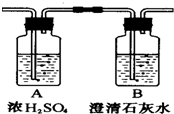
燃烧法是测定有机化合物化学式的一种重要方法.(1)现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得A装置增重10.8g,B装置增重22g.求该烃的分子式.
(2)若已知某烃为乙烯的同系物,0.5mol的该烃在足量的氧气中完全燃烧后的产物通过盛有足量过氧化钠的干燥管,干燥管的质量增加45g,
求:该烃的化学式、结构简式;写出该烃与溴的四氯化碳溶液反应的化学方程式.
分析 (1)根据浓硫酸具有吸水性,增重10.8g为水的质量,石灰水增重的质量为二氧化碳的质量,计算水、二氧化碳的物质的量,根据元素守恒确定烃的分子式;
(2)若已知某烃为乙烯的同系物,燃烧生成二氧化碳与水的物质的量之比为1:1,完全燃烧后的产物通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,根据干燥管质量增重计算二氧化碳、水的物质的量,再根据C、H原子守恒确定烃的分子式,书写可能的结构简式.
解答 解:(1)浓硫酸具有吸水性,增重10.8g为水的质量,则n(H2O)=$\frac{10.8g}{18g/mol}$=0.6mol,n(H)=2n(H2O)=2×0.6mol=1.2mol,所以该烃分子中H原子个数为$\frac{1.2mol}{0.1mol}$=12,
石灰水增重的22g质量为二氧化碳的质量,则n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为$\frac{0.5mol}{0.1mol}$=5,
所以该烃的分子式为C5H12,
答:该烃的化学式C5H12;
(2)若已知某烃为乙烯的同系物,燃烧生成二氧化碳与水的物质的量之比为1:1,完全燃烧后的产物通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,设二氧化碳、水的物质的量均为xmol,则x mol×28g/mol+xmol×2g/mol=45,故x=1.5,该烃分子中C原子数目为$\frac{1.5mol}{0.5mol}$=3,H原子数目为$\frac{1.5mol×2}{0.5mol}$=6,故该烃分子式为C3H6,结构简式为:CH2=CH-CH3,与溴的四氯化碳溶液反应的化学方程式为CH2=CH-CH3+Br2→BrCH2CHBrCH3,
答:该烃分子式为C3H6,结构简式为:CH2=CH-CH3,与溴的四氯化碳溶液反应的化学方程式为CH2=CH-CH3+Br2→BrCH2CHBrCH3.
点评 本题考查有机物分子式确定的计算,(2)中注意利用差量法理解二氧化碳、水与过氧化钠反应固体增重问题,侧重考查学生分析计算能力,难度中等.

| A | B | ||
| C | D | E |
(2)B的气态氢化物与其最高价氧化物对应水化物可形成盐,其盐溶液显酸性(填“酸性”、“中性”或“碱性”)用离子方程式表示其原因:NH4++H2O?NH3.H2O+H+.
(3)写出C元素原子的价电子排布式:3s23p1比较B、E元素基态原子的第一电离能大小N>S(用元素符号填空).
(4)A与氢元素形成最简单化合物H可作为燃料电池的原料,写出该燃料电池(以足量NaOH溶液作为电解质溶液)负极电极反应CH4+10 OH--8e-=CO32-+7H2O已知25℃/101kPa下,H的燃烧热为890kJ•mol-1,写出H燃烧热的化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1.
(5)向150ml.0.10•L-1的氯化物溶液中加入40mLNaOH溶掖,充分反应后得到0.78g沉淀.则原NaOH溶液的物质的量浓度可能是0.75或1.5mol•L-1.
| A. | 生成的水分子中含有18O | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成 45g 乙酸乙酯 | D. | 不可能生成 90g 乙酸乙酯 |
| A. | C4H10和C5H12 | B. | C2H6和C3H6 | C. | C2H2和C4H6 | D. | C3H6和C4H8 |
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| C. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
| A. | N60与N2是同素异形体 | B. | N60一定是比N2更稳定的分子 | ||
| C. | N60的相对分子质量为840 | D. | N60可能是一种很好的火箭燃料 |
