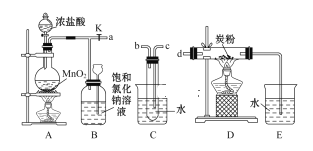
题目内容
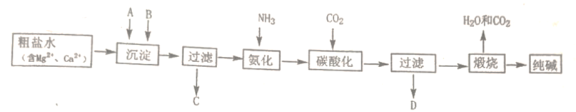
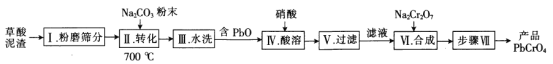
【题目】一种用草酸泥渣(含73.75%PbC2O4、24.24%PbSO4)制备PbCrO4的工艺流程如下:
回答下列问题:
已知:①PbC2O4完全分解的化学方程式为![]() 。
。
②PbCrO4难溶于水。
(1)泥渣“粉磨筛分”的目的是___________________________________。
(2)用Na2CO3将PbSO4转化为PbCO3的目的是_______________________;若在水溶液中进行![]() ,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
(3)步骤Ⅵ“合成”时发生反应的化学方程式为____________________。
(4)“步骤Ⅶ”包含的实验操作有___________________________________及干燥。
(5)某工厂用10t该草酸泥渣制备PbCrO4,最终得到9.69t产品,Pb元素的转化率为_______(精确到小数点后2位)。
【答案】使反应速率加快 将难以热分解的硫酸铅转化为易分解的碳酸铅; 2.5×105 2Pb(NO3)2+Na2Cr2O7+H2O=2PbCrO4↓+2NaNO3+2HNO3 过滤、洗涤 90.91%
【解析】
(1)泥渣“粉磨筛分”后,颗粒变小,与溶液充分接触效果好;
(2)PbSO4不溶于水,加热不分解,Na2CO3将PbSO4转化为PbCO3,不溶于水,且加热分解;
(3)滤液中的硝酸铅与重铬酸钠反应生成铬酸铅、硝酸钠和硝酸;
(4)固液分离,采用过滤、洗涤、干燥;
(5)转化率为实际产量/理论产量×100%。
(1)泥渣“粉磨筛分”后,颗粒变小,与溶液充分接触效果好,提高反应速率;
(2)PbSO4不溶于水,加热不分解,Na2CO3将PbSO4转化为PbCO3,不溶于水,且加热易分解;根据反应式可知,K=c(SO42-)/c(CO32-)=KSP(PbSO4)/KSP(PbCO3)=2.5×105;
(3)滤液中的硝酸铅与重铬酸钠反应生成铬酸铅、硝酸钠和硝酸,反应的方程式:2Pb(NO3)2+Na2Cr2O7+H2O=2PbCrO4↓+2NaNO3+2HNO3;
(4)PbCrO4难溶于水,则固液分离,采用过滤、洗涤、干燥,可得到纯净的PbCrO4;
(5)根据Pb元素守恒,10t草酸泥含有Pb的质量为10t×73.75%×207/295+10t×24.24%×207/303=6.831t,理论可生成PbCrO4的质量为6.831t×323/207=10.659t,实际生成9.69t,则转化率为9.69t/10.659t×100%=90.91%。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
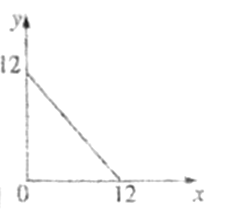
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。