题目内容
【题目】镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________,HNO3表现了______________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
【答案】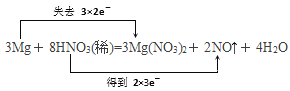 NO 氧化性,酸性 0.2 mol
NO 氧化性,酸性 0.2 mol
【解析】
(1)Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O,Mg元素的化合价由0价变成了+2价,化合价升高2,N元素的化合价由+5价变成了+2价,化合价降低3,最小公倍数是6,Mg系数为3,Mg(NO3)2系数为3,NO的系数为2,通过观察反应前后N守恒,HNO3系数为8,最后H守恒,H2O的系数为4,得出:3Mg+8HNO3(稀)=3 Mg(NO3)2+2NO↑+3H2O;用“双线桥”表示电子转移方向和数目为 ;
;
故答案为:
(2)N元素的化合价降低被还原,因此NO是还原产物,同时反应后存在NO3-,HNO3既表现氧化性,又表现酸性;
故答案为:NO;氧化性,酸性;
(3)HNO3→NO,1molHNO3被还原转移3mole-,转移0.6mol电子,则被还原的硝酸的物质的量0.2mol;
故答案为:0.2mol

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-