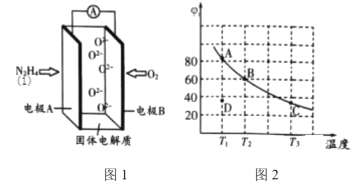
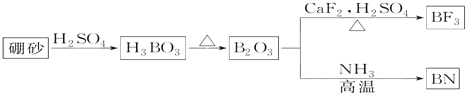
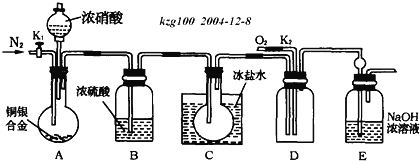
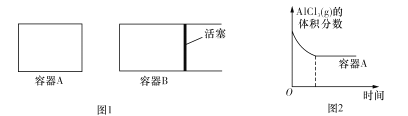
题目内容
【题目】可逆反应:3A(g)3B(?)+C(?)-Q,(Q>0). 随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
A.B和C可能都是固体B.B和C一定都是气体
C.若C为固体,则B一定是气体D.B和C可能都是气体
【答案】D
【解析】
该反应正反应吸热,升高温度平衡正向移动,气体平均相对分子质量有变小趋势,说明气体的物质的量增大或气体总物质的量不变而气体总质量减小,据此分析解答。
因为该可逆反应△H>0,正反应方向吸热,所以温度升高,平衡向正反应方向进行。而气体平均相对分子质量(Mr)=![]() ,Mr变小,则气体总质量减小或气体总物质的量增大,
,Mr变小,则气体总质量减小或气体总物质的量增大,
A、若B、C均为固体,则只有气体A,则Mr保持恒定不变,不符号题意,故A错误;
B、若B、C均为气体,则气体总质量不变,气体总物质的量增大,则Mr变小;如果若B为气体,C为固体,则气体总质量减小,气体总物质的量不变,则Mr变小,所以B、C不一定都是气体,故B错误;
C、若B为固体,C为气体,则气体总质量减小,气体总物质的量减小,则Mr不确定如何变化,故C错误;
D、若B、C均为气体,则气体总质量不变,气体总物质的量增大,则Mr变小,符合题意,故D正确。
答案选D。

练习册系列答案
相关题目