题目内容
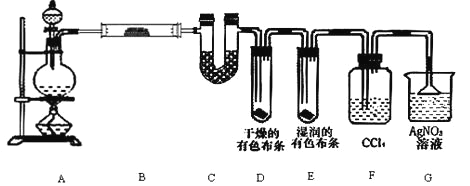
【题目】某校化学实验兴趣小组为了要探究实验室制备 Cl2 的过程中会有水蒸气和 HCl 挥发出来,同时要 证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 在标准状况下体积总 是________________1.12L(填“大于”或“等于”或“小于”),原因是________________。
(2)①装置 B 中盛放的试剂名称为__________,作用是________________
②装置 D 和 E 中出现的不同现象说明了________________
③装置 F 的作用是________________
④写出装置 G 中发生主要反应的离子方程式为________________.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了 确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间 再加一个装置.你认为该装置应加在________________与________________之间(填装置字母序号),装置中应放入________________(填写试剂或用品名称).
【答案】 小于 随着反应的进行浓盐酸的浓度逐渐变稀,稀盐酸与 MnO2 不反应 无水硫酸铜 证明有水蒸气产生 氯气无漂白性,次氯酸有漂白性 吸收氯气 Ag++Cl-→AgCl↓ F G 湿润的淀粉 KI 试纸
【解析】(1)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消化氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,制得的Cl2在标准状况下体积总是小于1.12L;
(2)①硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气;
②干燥的有色布条不褪色,说明氯气不具有漂白性;湿润的有色布条褪色,氯气与水反应生成盐酸与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸漂白性;
③用四氯化碳吸收氯气,防止干扰G中氯化氢的检验;
④氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-═AgCl↓;
(3)氯气与水反应会生成盐酸,干扰G中氯化氢的检验,故在F、G之间加一装置,用碘化钾淀粉试液检验氯气是否被完全吸收。