题目内容
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:_______________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):_______________________。
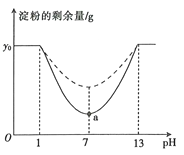
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。
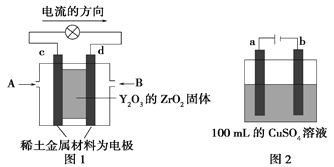
①c电极的名称为________,d电极上的电极反应式为__________________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=______(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_____(填序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
【答案】 2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 096.7 kJ·mol-1 高压、低温(或加压、降温) 正极 CH4-8e-+4O2-===CO2+2H2O 4OH--4e-===2H2O+O2↑ 1 ac
【解析】(1)本题考查热化学反应方程式的计算,①N2H4与N2O4反应的方程式为:2N2H4+N2O4=3N2+4H2O,①N2(g)+2O2(g)=N2O4(g),②N2H4(g)+O2(g)=N2(g)+2H2O(g)②×2-①得出:N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=[2×(-543)-10.7]kJ·mol-1=-1 096.7 kJ·mol-1;②N2O4![]() 2NO2,促使平衡向逆反应方向进行,可以增大压强,此反应属于吸热反应,也可以降低温度;(2)①考查原电池的工作原理和电极反应式的书写,根据电流的方向,电流从正极流向负极,即c为正极,d为负极,通入的B为CH4,电解质传导O2-,因此负极电极反应式为:CH4+4O2--8e-=CO2+2H2O;②考查电解原理以及关于电解的计算,a连接电源的正极,a为阳极,a电极反应式为4OH--4e-=2H2O+O2↑;电解CuSO4溶液总反应方程式为2Cu2++2H2O
2NO2,促使平衡向逆反应方向进行,可以增大压强,此反应属于吸热反应,也可以降低温度;(2)①考查原电池的工作原理和电极反应式的书写,根据电流的方向,电流从正极流向负极,即c为正极,d为负极,通入的B为CH4,电解质传导O2-,因此负极电极反应式为:CH4+4O2--8e-=CO2+2H2O;②考查电解原理以及关于电解的计算,a连接电源的正极,a为阳极,a电极反应式为4OH--4e-=2H2O+O2↑;电解CuSO4溶液总反应方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,假设Cu2+全部被电解成Cu,此时产生氧气的物质的量为100×10-3×0.5/2mol=0.025mol,体积为0.025×22.4L= 0.56L>56mL,因此Cu2+没有完全电解,因此有n(H+)=56×10-3×4/22.4mol=0.01mol,c(H+)=0.01/100×10-3mol·L-1=0.1mol·L-1,则pH=1; 根据上述分析,只电解部分Cu2+,因此恢复到电解前的在状态,应加入CuO或CuCO3,即ac正确。
2Cu+O2↑+4H+,假设Cu2+全部被电解成Cu,此时产生氧气的物质的量为100×10-3×0.5/2mol=0.025mol,体积为0.025×22.4L= 0.56L>56mL,因此Cu2+没有完全电解,因此有n(H+)=56×10-3×4/22.4mol=0.01mol,c(H+)=0.01/100×10-3mol·L-1=0.1mol·L-1,则pH=1; 根据上述分析,只电解部分Cu2+,因此恢复到电解前的在状态,应加入CuO或CuCO3,即ac正确。

【题目】(1) 良好的生态环境可以提升生活质量。
① 下列物质不属于空气质量周报中污染物的是________(填字母)。
a. SO2 b. NO2 c. PM2.5
② 垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________(填字母)标志的垃圾桶内。

③ 燃烧煤产生的SO2所形成的酸雨中,SO2最终转化成的酸是________(填化学式)。
(2) 右图是某品牌调料标签的一部分。

① 配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生________反应得到。
② 小麦粉中的主要营养物质是________。
③ 配料表中属于防腐剂的是________。
④ 配料表中的辣椒红是着色剂。亚硝酸钠也可作着色剂,但亚硝酸钠有毒,要严格控制其用量。亚硝酸钠外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 | 亚硝酸钠 | 氯化钠 |
1. 酸性条件下的稳定性 | 微热分解为NO和NO2 | 微热时不分解 |
2. 熔点 | 271 ℃ | 801 ℃ |
3. 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:________。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 钢铁是应用广泛的金属材料。钢铁在潮湿空气中易生锈,铁锈的主要成分是____________(填化学式),请列举一种防止钢铁腐蚀的方法:________。
② 水泥、玻璃、陶瓷是生活中常见的硅酸盐材料。制备普通玻璃的原料有CaCO3、________和________(填化学式)。青瓷是中国最早发明的瓷器,青瓷表面的绿色是釉层中的________价铁元素显色而成的。
③ 氮化硅陶瓷抗腐蚀能力强,工业上可用四氯化硅和氮气在氢气气氛中加强热发生反应制得。请写出该反应的化学方程式:________。