题目内容
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
【答案】(1)1.0×10-7 mol ·L-1
(2)5.0×10-14mol ·L-1
(3)19:11
(4)②③⑤⑥
【解析】
试题分析:(1)HA的电离平衡常数Ka=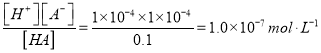 ;(2)0.1mol·L-1的H2SO4中,硫酸电离的C(H+)=0.2mol·L-1,水电离出的C(H+)为
;(2)0.1mol·L-1的H2SO4中,硫酸电离的C(H+)=0.2mol·L-1,水电离出的C(H+)为![]() 5.0×10-14mol ·L-1;(3)
5.0×10-14mol ·L-1;(3)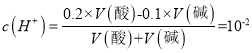 ,则所需NaOH溶液与硫酸的体积比为19:11;(4)①酸溶液越稀释c(H+)越小;② 弱酸越稀越电离,电离度(α)增大;③酸溶液越稀释c(H+)越小,
,则所需NaOH溶液与硫酸的体积比为19:11;(4)①酸溶液越稀释c(H+)越小;② 弱酸越稀越电离,电离度(α)增大;③酸溶液越稀释c(H+)越小,![]() 不变,所以c(OH-)增大;④ Ka只与温度有关,Ka不变;⑤
不变,所以c(OH-)增大;④ Ka只与温度有关,Ka不变;⑤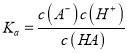 不变,c(H+)变小,c(A-)/ c(HA)增大;⑥弱酸越稀越电离,电离度(α)增大,所以n(A-)增大。
不变,c(H+)变小,c(A-)/ c(HA)增大;⑥弱酸越稀越电离,电离度(α)增大,所以n(A-)增大。

 阅读快车系列答案
阅读快车系列答案【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/mol·L-1 | 反应后溶液的PH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | X | 0.2 | 7 |
下列判断不正确的是
A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 实验①反应后的溶液中:c(OH-)= c(K+)-c(A_)=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)> c(OH-)=c(H+)