题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________,可燃冰(mCH4·nH2O)属于________晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
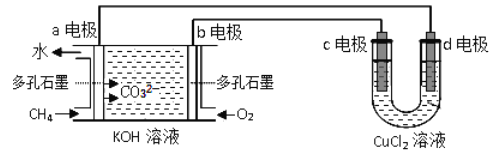
①b电极名称为___________,d电极的电极反应式为_________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:
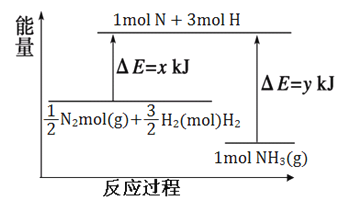
己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。则y=___________。
2NH3(g) △H=-92kJ·mol-1。则y=___________。
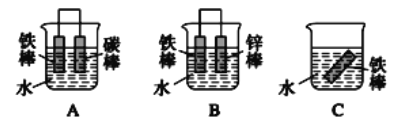
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________(填字母)。
【答案】 四面体 分子 -890.4 正极 Cu2++2e-=Cu 560 B 1173 A>C>B
【解析】(1)①甲烷为四面体结构,mCH4nH2O的熔沸点较低,为分子晶体;
②1g甲烷完全燃烧生成液态水放出55.64kJ热量,则1mol甲烷燃烧放出的能量为16×55.64=890.24;
(2)①a极通的是燃料甲烷,所以是负极;d电极与电源的负极相连,为电解池的阴极,发生还原反应,电极反应式为Cu2++2e-=Cu;
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,整个电路转移的物质的量为![]() ×2=0.05mol×2=0.1mol,消耗氧气的物质的量为
×2=0.05mol×2=0.1mol,消耗氧气的物质的量为![]() ×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L=560mL;
×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L=560mL;
(3)A组:2H2(g)+O2(g)═2H2O(g)△H1,2H2(g)+O2(g)═2H2O(l)△H2,气态水具有的能量大于液态水,所以氢气燃烧生成气态水时放出的热量较少,生成液态水时放出的热量较多,氢气的燃烧反应为放热反应,△H小于零,反应放热越多,则△H越小,所以△H1>△H2;B组:固体硫燃烧时要先变为气态硫,过程吸热,所以气态硫具有的能量高,即气态硫放出的热量多,但反应热为负值,所以△H1<△H2;C组:1mol碳完全燃烧放出的热量大于不完全燃烧放出的热量,但反应热为负值,所以△H1>△H2;D组:2molCO完全燃烧放出的热量大于1molCO完全燃烧放出的热量,但反应热为负值,所以△H1>△H2;故答案为B组;
(4)该反应放热,反应热=反应物的键能-生成物的键能,氮气和氢气反应生成氨气的热化学方程式为: ![]() N2(g)+
N2(g)+ ![]() H2(g)=NH3(g)△H=x-y kJmol-1,则N2(g)+3H2(g)=2NH3(g)△H=2(x-y)kJmol-1=-92kJmol-1,所以x-y=-46,又因x=1127,所以y=1173;
H2(g)=NH3(g)△H=x-y kJmol-1,则N2(g)+3H2(g)=2NH3(g)△H=2(x-y)kJmol-1=-92kJmol-1,所以x-y=-46,又因x=1127,所以y=1173;
(5)C发生化学腐蚀,A中铁发生电化学腐蚀,B中锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为A>C>B。

 阅读快车系列答案
阅读快车系列答案【题目】某化学反应2A![]() B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1. 0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据述数据,回答下列问题 :
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为________ 。
(2)在实验1中,c1数值为 ________ 。
(3)在实验1、2中有一个实验使用了正催化剂。判断是实验 ________ (选填“1”或“2”)使用了正催化剂。
(4)在实验1、3中反应温度不同。判断T3 ________ 800(选填“﹤”或“﹥”)。