题目内容
4.A、B、C、D、E五种物质均是由两种离子组成,它们均可溶于水并完全电离,电离出的所有离子如下表所示:| 阳离子 | Na+、Al3+、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、OH-、NO3-、CO32-、X |
体,则离子X的符号为SO42-.
(2)将0.02mol A与0.O1mol C同时溶解在足量的蒸馏水中,充分反应后最后得到的沉淀质量为6.1g (精确到0.1g).
分析 (1)因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3和Ba(OH)2,C与B的溶液混合时,产生红褐色沉淀和无色无味气体,沉淀为氢氧化铁、气体为二氧化碳;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则B为Na2CO3,A为Ba(OH)2,C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝;
(2)已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,根据反应方程中的关系求出沉淀的量.
解答 解:(1)因Al3+、Mg2+、Fe3+和OH-反应生成沉淀,Al3+、Mg2+、Ba2+、Fe3+和CO32-反应,则不能共存,所以一定存在的物质为Na2CO3和Ba(OH)2,根据C与B的溶液混合时,产生红褐色沉淀和无色无味气体,可知沉淀为氢氧化铁、气体为二氧化碳,则B为Na2CO3,A为Ba(OH)2;C与A的溶液混合时产生混合物沉淀,向该沉淀中滴入稀盐酸,沉淀部分溶解,最后留有白色沉淀不再溶解,则C为硫酸铁,另两种物质为氯化铝、硝酸镁或氯化镁、硝酸铝,因C为Fe2(SO4)3,则阴离子有SO42-,则X为SO42-,
故答案为:Na2CO3、Ba(OH)2;SO42-;
(3)已知C为Fe2(SO4)3,A为Ba(OH)2,将0.02molA与0.01molC同时溶解在足量的蒸馏水中,反应生成碳酸钡沉淀和氢氧化铁沉淀,Fe2(SO4)3+3Ba(OH)2═2Fe(OH)3↓+3BaSO4↓,根据方程式可知,硫酸铁过量,按照Ba(OH)2计算,
则n(BaSO4)=0.02mol,n(Fe(OH)3)=$\frac{2}{3}$×0.02mol,
所以沉淀的质量为m(BaSO4)+m(Fe(OH)3)=0.02mol×233g/mol+$\frac{2}{3}$×0.02mol×107g/mol=6.1g,
故答案为:6.1g.
点评 本题考查离子推断、实验方案设计等,是对所学知识的综合考查,题目难度较大,综合度较高,旨在考查学生的推断能力与方案设计能力,注意根据反应现象进行推断.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 用纯碱溶液可鉴别出CCl4、C6H6、C2H5OH、CH3COOH | |
| B. | 用溴水、苯、铁屑制取溴苯 | |
| C. | 将无水乙醇加热到170℃制取乙烯 | |
| D. | 将冰醋酸、乙醇和2mol/L的硫酸加热制取乙酸乙酯 |
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液.
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气.
| 物质 | 加入试剂 | 操作方法 |
| ①苯(苯甲酸) | (2) | (4) |
| ②乙酸乙酯(乙醇) | (5) | (4) |
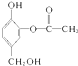 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol. | A. | 按系统命名法,化合物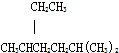 的名称为2-甲基-5-乙基已烷 的名称为2-甲基-5-乙基已烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物 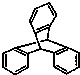 是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
| A. | $\stackrel{+}{C}$H20 | B. | $\stackrel{+}{N}$H3 | C. | $\stackrel{+}{B}$F3 | D. | 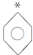 |
| A. | Al在氧气中燃烧生成A12O3,将Al粉改为Al片 | |
| B. | Fe与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 | |
| C. | Zn与稀硫酸反应时,适当提高溶液的温度 | |
| D. | Na与水反应时增大水的用量 |
 H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
H++CH3COO-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )