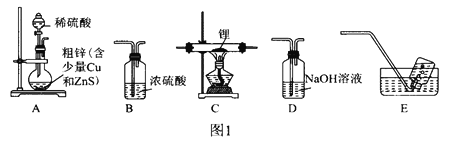
题目内容
【题目】宇宙飞船上常使用氢氧燃料电池,其电极总反应式为:2H2+O2=2H2O;若电解质溶液为KOH溶液,则下列叙述正确的是:
A. 此电池能见到浅蓝色火焰 B. H2为正极,O2为负极
C. 工作时电解液中OH-的物质的量不断增加 D. 电极反应中: H2失电子; O2得电子
【答案】D
【解析】A.该电池中氢气不燃烧,所以不能见到浅蓝色火焰,A错误;B.该原电池中,负极上通入氢气,正极上通入氧气,B错误;C.电池反应式为:2H2+O2=2H2O,根据方程式知,电解质溶液中氢氧根离子的物质的量不变,C错误;D.负极上电极反应式为:2H2+4OH--4e-=4H2O,正极上电极反应式为:O2+2H2O+4e-=4OH-,所以负极上氢气失电子,正极上氧气得电子,D正确;答案选D。
点睛:本题考查燃料电池,明确正负极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式的书写要结合电解质溶液的酸碱性,有时还需要考虑交换膜以及是不是熔融的电解质等。
【题型】单选题
【结束】
21
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
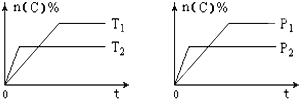
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
【答案】B
【解析】A.先拐先平数值大,由右图可知,P2>P1,故A错误;B. 先拐先平数值大,由左图可知,T2>T1,升高温度C的物质的量分数减小,说明升高温度平衡逆向移动,则该反应为放热反应,ΔH < 0,故B正确;C. 由右图可知,P2>P1,增大压强C的物质的量分数减小,说明增大压强平衡逆向移动,则逆反应方向为气体体积减小的方向,所以化学方程式系数a<c+d,故C错误;D. 使用催化剂不能使化学平衡发生移动,则C的物质的量分数不变,故D错误;答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
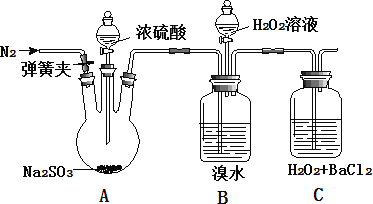
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。