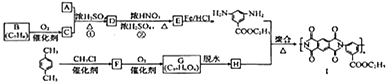
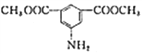
��Ŀ����
����Ŀ���⻯���(IiAlH4)���л��ϳ��е���Ҫ��ԭ����ij���������ʵ���Ʊ��⻯��﮲��ⶨ�䴿�ȡ���֪: �⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ��������ͬһ�����塣
�ش���������:
I.�Ʊ��⻯�(IiH)
ѡ��ͼ1�е�װ���Ʊ��⻯�(��Ҫʱ���ظ�ʹ��):
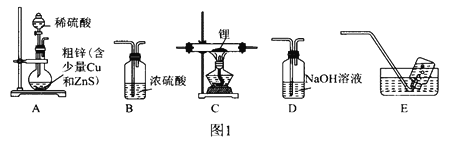
(1)װ��D��NaOH��Һ��������________________________________________��
(2)װ�õ�����˳��(������ʯ)ΪA��__________________________________��
(3)�����װ�õ�����������ȼ�ƾ���ǰ����е�ʵ�������____________________________________��
II.�Ʊ��⻯����
1947 ����Schlesinger��Bond ��Finholt�״��Ƶ��⻯�������䷽����ʹ�⻯�����ˮ���Ȼ������������������л�ϣ����裬��ַ�Ӧ������һϵ�в����õ�LiAlH4���塣
(4)�����ѻ�Ϊȥ����ˮ�Ƿ���������������:____________________________________��
(5)�⻯�����ˮ���Ȼ�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
III.�ⶨ�⻯��﮲�Ʒ(�����⻯�)�Ĵ�����

(6)��ͼ2װ�����������װ�������Բ�װ��ԼƷ(Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ�)��������Ӧ�IJ�����_________________������֮ǰ�������ƹ����������Ҳ��������ʹ���������������Һ����ͬһˮƽ��������Ŀ����___________________________��
(7)��״���£���Ӧǰ�����ܶ���ΪV1mL����Ӧ��ϲ���ȴ֮�������ܶ���ΪV2mL������Ʒ�Ĵ���Ϊ_____________________(�ú�a��V1��V2�Ĵ���ʽ��ʾ)������ʼ����ʱ���ӿ̶��ߣ���õĽ����___________(����ƫ������ƫ����������Ӱ����)��
���𰸡� ��ȥH2�л��е�H2S DBCBE ��װ��A�з�Һ©���Ļ����Ͳ�������һ��ʱ�����С�Թ���װ��E��ˮ�����ռ����岢�鴿 �����У���Ϊ�⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ 4LiH+AlCl3==LiAlH4+3LiC1 ��бY�ιܣ�������ˮע��ag��Ʒ�� ʹ�������������ѹǿ�����ѹǿ��� {[19(V2�CV1)]/448a}% ƫ��
��������ѡ��ͼ1�е�װ���Ʊ��⻯ﮣ�Ӧ������װ��A��ȡ���������Ƶ������к������⼰ˮ������ͨ��װ��D������������Һ�����ⷴӦ��ȥ�����е����⣬��ͨ��װ��BŨ�������õ������������������������ڼ��������·�Ӧ�����⻯ﮣ�������װ��B��ֹ�����е�ˮ��������װ��C�����δ��Ӧ�������ռ�������������������ը��(1)װ��D��NaOH��Һ�������dz�ȥH2�л��е�H2S��(2)װ�õ�����˳��(������ʯ)ΪA��DBCBE��(3)�����װ�õ�����������ȼ�ƾ���ǰ����е�ʵ������Ǵ�װ��A�з�Һ©���Ļ����Ͳ�������һ��ʱ�����С�Թ���װ��E��ˮ�����ռ����岢�鴿��(4)�����ѻ�Ϊȥ����ˮ����������Ϊ�⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ��(5)�⻯�����ˮ���Ȼ�����Ӧ����LiAlH4��LiC1����Ӧ�Ļ�ѧ����ʽΪ4LiH+AlCl3==LiAlH4+3LiC1��(6) Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ���������Ӧ�IJ�������бY�ιܣ�������ˮע��ag��Ʒ�У�����֮ǰ�������ƹ����������Ҳ��������ʹ���������������Һ����ͬһˮƽ��������Ŀ����ʹ�������������ѹǿ�����ѹǿ��ȣ�(7)���ݷ�ӦLiAlH4+2H2O==4H2��+LiAlO2��֪����Ʒ�Ĵ���Ϊ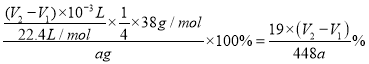 ������ʼ����ʱ���ӿ̶��ߣ�����������ƫ�ⶨ�����ƫ����
������ʼ����ʱ���ӿ̶��ߣ�����������ƫ�ⶨ�����ƫ����

����Ŀ������Co�����仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л�����,ijѧ��������������������к���Al��Li��Co2O3��Fe2O3����������

��֪:�������ܽ���:LiF������ˮ,Li2CO3����ˮ;
�ڲ��ֽ��������γ��������������pH���±���
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(��ʼ����) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(��ȫ����) | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�:
��1���������еõ�������Һ�ķ�Ӧ�����ӷ���ʽ��__________��
��2��д����������Co2O3�����ᷴӦ����Cl2�����ӷ���ʽ:______��
��3����������Na2CO3��Һ�������ǵ�����Һ��pH,Ӧʹ��Һ��pH������______;�����е���Ҫ�ɷֳ���LiF��,����______��
��4��NaF����Һ�е�Li+�γ�LiF����,�˷�Ӧ�Բ����������������______��
��5���ڿ����м���5.49 g�����ܾ�����CoC2O4��2H2O����Ʒ,���ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ�������,�����������
�¶ȷ�Χ/�� | ��������/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
�ټ��ȵ�210 ��ʱ,�������������ԭ����__________��
�ھ��ⶨ,���ȵ�210~290 �������е�������ֻ��CO2���ܵ�������span>,�˹��̷�����Ӧ�Ļ�ѧ����ʽΪ___________��[��֪M(CoC2O4��2H2O)=183 g��mol-1]