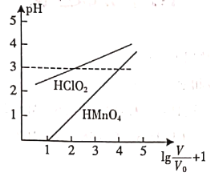
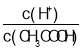题目内容
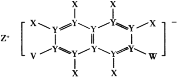
【题目】X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰;五种元素可以组成一种有机盐(如图所示)。下列说法正确的是( )
A.Y与W形成的分子中各原子最外层均满足8电子稳定结构
B.原子半径的大小关系为:V >Z > W
C.热稳定性:X与V组成的二元化合物>X与W组成的二元化合物
D.Y与V组成的二元化合物分子中含有两个Y-V键
【答案】A
【解析】
X、Y、Z、V、W五种短周期元素,原子序数依次增大,其中Z的原子半径最大,Z的单质在W的单质中燃烧产生黄色火焰;结合有机盐结构可知,Z为Na,从有机盐的结构可知,X形成单键,Y形成4根键,则Y为C,X为H,V和W也形成单键,整个阴离子带一个负电荷,则V和W有一个通过共用一个电子对达到稳定结构,而另一个通过共用一个电子对以及得到一个电子从而达到稳定结构,则最外层电子数分别为6和7,V和W分别是S和Cl。
A.Y和W形成的分子,如CCl4,各原子均满足8电子稳定结构,A正确;
B.同周期元素原子,从左到右,半径越来越小,则原子半径排序为Z(Na)>V(S)>W(Cl),B错误;
C.同周期元素的非金属性从上左到右逐渐增强,非金属性越弱,气态氢化物的稳定性差,X与V组成的二元化合物(H2S)的稳定性弱于X和W组成的二元化合物(HCl),C错误;
D.C和S构成的二元化合物,CS2中C和S之间为双键,D错误。
答案选A。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图:
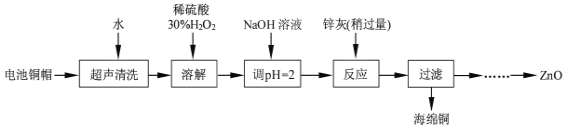
(1)①写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式___。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是___。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。
实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI↓(白色)+I2,2S2O32-+I2=2I-+S4O62-
滴定选用的指示剂为___,达到滴定终点观察到的现象为___。
(3)常温下,若向50mL0.0001mol/LCuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu(OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;
②___;③过滤;④___;⑤过滤、洗涤、干燥;⑥900℃煅烧。
【题目】为达到下表中的实验目的,请选择合适的试剂和方法.
实验目的 | 试剂及方法 |
①除去碳酸钠粉末中混入的碳酸氢钠杂质 | _____ |
②鉴别Na2SO4溶液和(NH4)2SO4溶液 | _____ |
③除去SiO2中的Fe2O3 | _____ |
④除去FeCl2溶液中少量的FeCl3 | _____ |