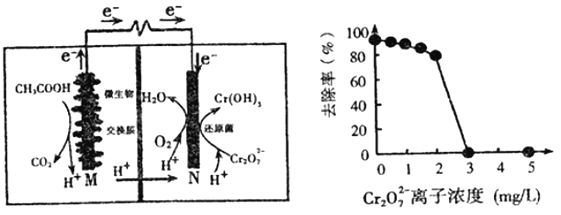
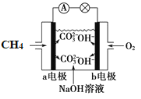
题目内容
【题目】在一定温度下的1L容器中,反应A(s)+2B(g)![]() C(g)+D(g)的K=1,当加入一定量反应物A和B,下列哪些物理量不再发生变化时己达到平衡状态的是
C(g)+D(g)的K=1,当加入一定量反应物A和B,下列哪些物理量不再发生变化时己达到平衡状态的是
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦B、C、D的分子数之比为1 : 1 : 1
A. ①③④⑤ B. ①③④⑤ C. ①②③④⑤⑦ D. ②③⑤⑦
【答案】D
【解析】
反应A(s)+2B(g)![]() C(g)+D(g)为气体体积不变的可逆反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答。
C(g)+D(g)为气体体积不变的可逆反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答。
①该反应为气体体积不变的反应,压强为常量,压强不变不能判断反应达到平衡状态,故①错误;
②有固体参加的反应,密度不变能判断达到平衡状态,故②正确;
③B的物质的量浓度不变时,说明正逆反应速率相等,该反应达到平衡状态,故③正确;
④气体体积不变的反应,混合气体的总物质的量不变时不能判断反应达到平衡状态,故④错误;
⑤有固体参加的反应,混合气体的平均相对分子质量不变,能判断达到平衡状态,故⑤正确;
⑥v(C)与v(D)的比值不变,不能说明各组分的浓度不再变化,则无法判断达到平衡状态,故⑥错误;
⑦反应A(s)+2B(g)![]() C(g)+D(g),B、C、D的分子数之比为1 : 1 : 1,在同温、同压、同体积的条件下,气体分子数之比等于物质的量之比,也等于浓度比,平衡常数K=
C(g)+D(g),B、C、D的分子数之比为1 : 1 : 1,在同温、同压、同体积的条件下,气体分子数之比等于物质的量之比,也等于浓度比,平衡常数K=![]() =
=![]() =1,说明达到平衡状态,故⑦正确。
=1,说明达到平衡状态,故⑦正确。
综合以上分析,②③⑤⑦正确,
所以D选项是正确的。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表,下列说法错误的是
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A. 当混合气体平均相对分子质量为26时说明该反应已达平衡
B. 达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大
C. 根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D. 因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在高温下自发进行