题目内容
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图为其工作原理和废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
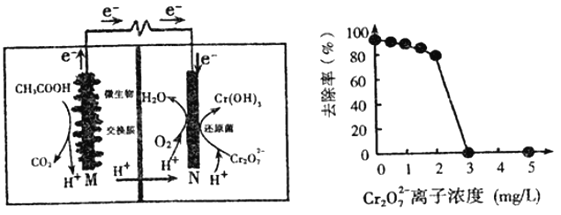
A. 反应一段时间后,N极附近的溶液pH下降
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. M为电池正极,CH3COOH被还原
【答案】C
【解析】
利用工作原理图中电子得失判断原电池的正负极,借助图像信息解答。
A.由图中信息可知,电池工作时,N极上氧气得到电子转化为水,氢离子浓度减小,故N附近溶液pH增大,选项A错误:
B.负极上CH3COOH被氧化生成CO2,负极的电极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,外电路转移4mol电子时,M 极产生标况下的22.4LCO2,选项B错误;
C.由图可知,Cr2O72-离子浓度较大时,其去除率几乎为0,因其有强氧化性和毒性,可能会造成还原菌的蛋白质变性而失活,选项C正确;
D.由图可知,该电池中有机物在微生物作用下发生氧化反应生成二氧化碳,M电极为负极;氧气和Cr2O72-被还原,N电极为正极,所以M为电源负极,有机物被氧化,选项D错误;
合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】根据实验操作,实验现象和所得出的结论不正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 取一小块镁带和一小片铝,用砂纸磨去表面的氧化膜,分别放入两支试管,再各加入同浓度同体积的盐酸 | 镁比铝产生气泡速率更快 | 金属性:Mg>Al |
B | 向某无色溶液中加入铜片和稀硫酸 | 试管口产生红棕色气体 | 该无色溶液中含有NO |
C | 向淀粉KI溶液中滴入3滴稀盐酸,再加入10%的H2O2溶液 | 滴入稀盐酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 取少量白色晶体于试管,加入氢氧化钠溶液并加热 | 试管口湿润蓝色石蕊试纸变红 | 白色晶体一定含有NH4+ |
A. AB. BC. CD. D




