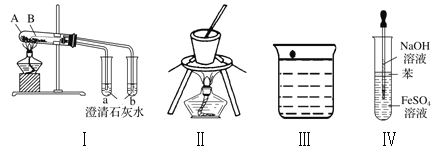
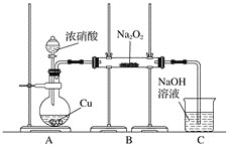
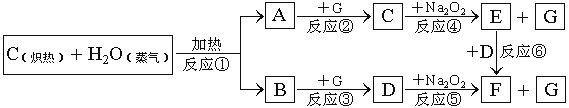
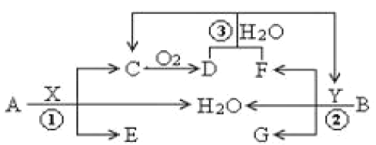
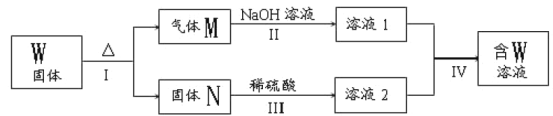
题目内容
【题目】某学生通过如图所示实验装置进行电化学实验。实验操作如下:①闭合S1,打开S2,持续20s。②打开S1,闭合S2,观察现象。下列说法不正确的是
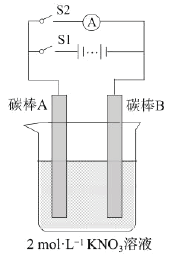
A.操作①时电极A为阳极,发生氧化反应
B.操作②时电极B为负极,电子由B处迁出
C.操作①时为电解池,操作②时为原电池
D.实验结束后,硝酸钾溶液的浓度保持不变
【答案】D
【解析】
本题综合考查原电池和电解池,原电池中负极失电子,发生氧化反应,正极得电子,发生还原反应,电子从负极经导线流向正极。电解池中,和正极相连的为阳极,失电子,和负极相连的作阴极,得电子,据此回答。
A.操作①时,电极和电源正极相连,为阳极,发生氧化反应,A正确;
B.操作②时,电极B为负极,电子从负极经导线流向正极,B正确;
C.操作①时,装置和电源相连,为电解池,操作②时,装置和电源断开,为原电池,C正确;
D.操作①时,实质是电解水,产生了氢气和氧气,部分逸散到空气中,导致硝酸钾溶液浓度增加,D错误;
故选D。

【题目】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___、___、___等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
1 | 0.60 | 10 | 480 | |||
2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____;
b.实验编号3的实验中KClO3的分解率为____%(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___(填分子式),可用____试纸检验,上述异常现象产生的原因是____;
(5)实验结论:____。