题目内容
【题目】某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是()
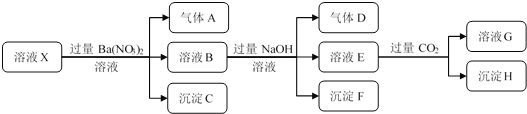
A. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为112ml(标况),则X中c(Fe2+)=0.05mol/L
【答案】B
【解析】
在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只能为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,那么一定含有SO42-离子,那么就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答。
依据分析可知:溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,一定不含有:Ba2+、CO32-、SO32-、NO3-,不能确定是否含有:Fe3+和Cl-,
A、依据分析可知,溶液中一定存在:NH4+、Al3+、Fe2+、SO42-,不能确定Cl-是否存在,选项A错误;
B、根据上述连续实验不能确定溶液X中是否含有Fe3+,选项B正确;
C、根据上述分析可知H为Al(OH)3,BaCO3与过量的二氧化碳生成碳酸氢钡,易溶于水,选项C错误;
D、生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为112 mL,物质的量为:![]() =0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)==0.15mol/L,选项D错误;
=0.005mol,故n(Fe2+)=3×0.005=0.015mol,c(Fe2+)==0.15mol/L,选项D错误;
答案选B。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案