题目内容
【题目】铜元素在化合物中其化合价可以呈现![]() 、
、![]() 价。
价。![]() 和
和![]() 是常见的
是常见的![]() 价铜的化合物,
价铜的化合物,![]() 是较为常见的
是较为常见的![]() 价铜的化合物。
价铜的化合物。
(1)铜元素位于周期表的_______区。
A、s B、p C、d D、ds E、f
(2)向![]() 溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较
溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式__________________。比较![]() 和
和![]() 中
中![]() 键角的大小:
键角的大小:![]() ___________
___________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)![]() 中阴离子的空间构型为_______,NO3-中的大π键应表示为______
中阴离子的空间构型为_______,NO3-中的大π键应表示为______
[信息:臭氧分子中,中心氧原子的未杂化的p轨道(含2个电子)与其它两个氧原子的p轨道(各含1个电子)肩并肩形成一个大π键,表示为![]() ,]
,]
![]() 的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
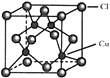
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②若以铜原子为顶点构成晶胞,面心原子为________(Cu、Cl)
【答案】D [Cu(NH3)SO4]H2O < 平面三角形 ![]() 4 Cu
4 Cu
【解析】
(1)29号元素Cu在元素周期表中位于第四周期第IB族,因此属于ds区;
(2)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,再向深蓝色透明溶液加入乙醇,会析出深蓝色的晶体Cu(NH3)4SO4H2O;由于NH3提供孤对电子与Cu2+形成配位键后,H-N-H成键电子对受到的排斥力减小,所以H-N-H键角增大;
(3)硝酸根离子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知硝酸根离子空间构型为平面三角形;在NO3-中,氮原子是四中心六电子π键;
(4)根据CuCl的晶胞结构进行分析。
(1)29号元素Cu在元素周期表中位于第四周期第IB族,因此属于ds区,故答案为:D。
(2)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再向深蓝色透明溶液加入乙醇,由于乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体Cu(NH3)4SO4H2O;由于NH3提供孤对电子与Cu2+形成配位键后,H-N-H成键电子对受到的排斥力减小,所以H-N-H键角增大,故答案为:[Cu(NH3)SO4]H2O,<。
(3)硝酸根离子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知硝酸根离子空间构型为平面三角形;在NO3-中,氮原子是sp2杂化,三个杂化轨道与三个氧形成三个σ键,氮剩下的两个电子加上三个氧的三个2p电子还有负电荷的一个电子一共是6个π电子,是四中心六电子π键,可以表示为![]() ,故答案为:平面三角形,
,故答案为:平面三角形,![]() 。
。
(4)①根据CuCl的晶胞结构结合化学式可以判断,每个Cl周围跟Cl原子距离最近且相等的Cu原子数目为4个,故答案为:4。
②有图可知,若以铜原子为顶点构成晶胞,面心原子为Cu,故答案为:Cu。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
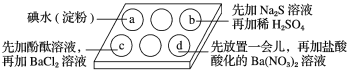
对实验现象的“解释或结论”错误的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 还原性:SO32->I- |
B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. AB. BC. CD. D