题目内容
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是: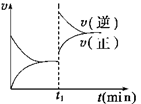
A.2A(g) + B(g) 2C(g) ΔH>0 2C(g) ΔH>0 |
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
C.H2(g) + I2(g)  2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0 4NO(g) + 6H2O(g)ΔH<0 |
D
解析试题分析:在t1时刻升高温度或增大压强,得到建立新平衡速率v(逆)>v(正),说明反应向逆向移动,其正反应的放热反应(ΔH<0)和气体计量数增大的反应。故D正确。
考点:判断反应的速率随时间变化图像与反应的对应关系。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案 已知在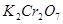 的溶液中存在着如下平衡:
的溶液中存在着如下平衡: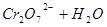
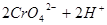 加入下列物质能使溶液变为橙色的是
加入下列物质能使溶液变为橙色的是
(橙色) (黄色)
| A.氨水 | B.硫酸 | C.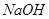 | D.水 |
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
| A.2v(NH3)=v(CO2) |
| B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的平均摩尔质量不变 |
| D.密闭容器中氨气的体积分数不变 |
用下列方法制取氢气,反应速率最大的是
| A.10℃时,粉末状锌与2 mol·L-1硫酸溶液反应 |
| B.30℃时,粉末状锌与2mol·L-1硫酸溶液反应 |
| C.10℃时,块状锌与2 mol·L-1硫酸溶液反应 |
| D.30℃时,块状锌与2 mol·L-1硫酸溶液反应 |
溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是
| A.通入乙烯气体 | B.通入SO2气体 | C.加入NaF晶体 | D.加入NaI晶体 |
下面关于化学反应的限度的叙述中,正确的是
| A.化学反应的限度都相同 |
| B.可以通过改变温度控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应的限度 |
| D.当一个化学反应在一定条件下达到限度时,反应即停止 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( ) 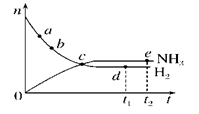
| A.c点处正反应速率和逆反应速率相等 |
| B.a点处正反应速率比b点处的大 |
| C.d点(t1时刻)和e点(t2时刻)处n(N2)不同 |
| D.t2时刻,正反应速率大于逆反应速率 |
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ、Ⅱ中正反应速率相同 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1 |
 2H2(g)+O2(g)。有关该反应的说法正确的是
2H2(g)+O2(g)。有关该反应的说法正确的是