题目内容
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ、Ⅱ中正反应速率相同 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1 |
A
解析

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
在恒温密闭容器中进行反应N2(g) + O2(g) = 2NO(g),下列反应措施能加快反应速率的是
| A.缩小体积使压强增大 | B.压强不变,充入N2使体积增大 |
| C.体积不变,充入He使压强增大 | D.压强不变,充入He使体积增大 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是: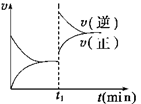
A.2A(g) + B(g) 2C(g) ΔH>0 2C(g) ΔH>0 |
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
C.H2(g) + I2(g)  2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0 4NO(g) + 6H2O(g)ΔH<0 |
下列事实不能用平衡移动原理解释的是
| A.钢铁在潮湿的空气中比在干燥空气中更容易生锈 |
| B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 |
| C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者 |
| D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 |
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |
下列图示与对应的叙述相符的是 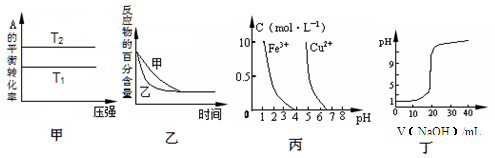
A.由图甲可以判断:对于反应aA(g)+ bB(g) cC(g),若T1>T2, 则a +b=c且 ?H<0 cC(g),若T1>T2, 则a +b=c且 ?H<0 |
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 |
| D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线 |
 2C(g),
2C(g), xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )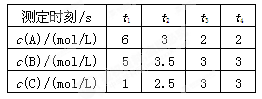
 2C
2C