题目内容
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
| A.2v(NH3)=v(CO2) |
| B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的平均摩尔质量不变 |
| D.密闭容器中氨气的体积分数不变 |
B
解析试题分析:A选项要从速率去判断是否达到平衡一定要有正的反应方向和逆的反应方向。所以A选项是错误的。B选项左右气体量不同,因此密闭容器中总压强不变时,可以表示化学反应已达到平衡的状态,所以B选项是正确的。C选项摩尔质量表示一摩尔的物质所具有的质量,因此不论达不达到平衡,其摩尔质量在数值上都等于相对原子或相对分子的质量。D选项由于反应物不是气体,只有生成物氨气和一氧化碳是气体,且是按比例生成的,又在密闭容器中,因此他们的体积分数在任何的时候都是不变的,所以D选项是错误的。
考点:考查化学反应平衡标志的相关知识点

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
已知有反应:I2(g)+H2(g)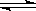 2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
| 选项 | X | Y |  |
| A | 温度 | 容器内混合气体的密度 | |
| B | I2的物质的量 | H2的转化率 | |
| C | H2的浓度 | 平衡常数K | |
| D | 加入Ar的物质的量 | 逆反应速率 |
在恒温密闭容器中进行反应N2(g) + O2(g) = 2NO(g),下列反应措施能加快反应速率的是
| A.缩小体积使压强增大 | B.压强不变,充入N2使体积增大 |
| C.体积不变,充入He使压强增大 | D.压强不变,充入He使体积增大 |
T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )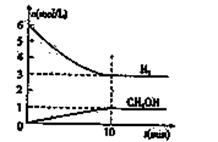
| A.0~10min内v(H2)=0.3mol/(L·min) |
B.T℃时,平衡常数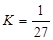 ,CO2和H2的转化率相等 ,CO2和H2的转化率相等 |
| C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量 |
| D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
下列措施对增大化学反应速率明显有效的是
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在K2SO4与BaCl2两溶液反应时,增大压强 |
| D.将铝片改为铝粉,做铝与氧气反应的实验 |
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是: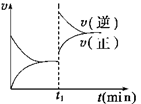
A.2A(g) + B(g) 2C(g) ΔH>0 2C(g) ΔH>0 |
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
C.H2(g) + I2(g)  2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0 4NO(g) + 6H2O(g)ΔH<0 |
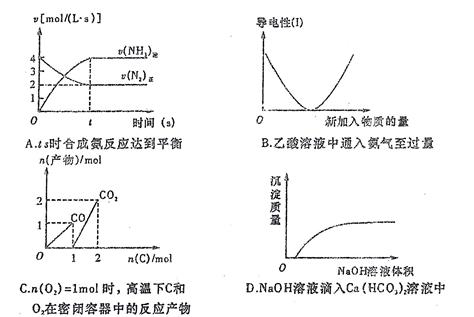
 2C(g),该反应进行到一定限度后达到化学平衡的标志是
2C(g),该反应进行到一定限度后达到化学平衡的标志是
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )