题目内容
【题目】甲醇是一种重要的有机化工原料,C02与H2在催化剂CZZA(普通铜基催化剂)作用下合成甲醇,相关反应如下:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1
CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(g)=H2O(l) △H3 = -44.0kJ·mol-1
请回答:
(1)反应Ⅱ的△H2 =___________________kJ·mol-1。
(2)研究表明:在其他条件相同的情况下,将催化剂CZZA换成新型催化剂(CZZA/rGO),可以显著提高甲醇的选择性,试用过渡态理论解释其原因:___________________。
(3)以CZZA/rGO为催化剂,在一定条件下,将物质的量之比为1:3(总量为a mol)的C02与H2通入恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如下图所示:
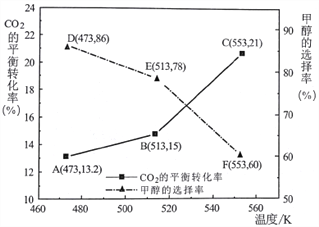
①在553K时,反应体系内甲醇的物质的量为___________________mol。
②随着温度的升高,C02的平衡转化率增加但甲醇的选择率降低,请分析其原因:__________________。
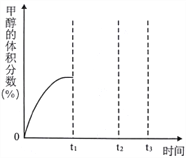
(4)将CO2与H2按物质的量之比为1:3通入恒温恒容密闭容器中,控制条件,使其仅仅按反应Ⅰ进行,得到甲醇的体积分数与时间的关系如上图2所示。保持其它条件不变,t1时再向容器中加入一定量物质的量之比为1:3的CO2与H2混合气,t2时再次达到平衡,请在下图中画出t1~t3时间内甲醇体积分数随时间的变化曲线。__________________
(5)在催化剂作用下,以NaOH溶液为电解液,将甲烷气体通入石墨复合电极,电解产生甲醇。写出阳极反应的电极反应式___________________。
【答案】 41.2 新型催化剂能将反应Ⅰ活化能降低更多,使反应物更容易生成甲醇 0.0315a 当温度升高时反应Ⅰ平衡逆向移动,而反应Ⅱ平衡正向移动且幅度更大,所以CO2的转化率增加,但甲醇的选择性却降低。  CH4 -2e- +2OH- =CH3OH+H2O
CH4 -2e- +2OH- =CH3OH+H2O
【解析】①CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol-1、②H2(g)+
O2(g)=CO2(g) △H=-283.0kJmol-1、②H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1,③H2O(g)=H2O(l) △H3 = -44.0kJ·mol-1,④反应Ⅰ CO2(g)+3H2(g)
O2(g)=H2O(l) △H=-285.8kJmol-1,③H2O(g)=H2O(l) △H3 = -44.0kJ·mol-1,④反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1,⑤反应Ⅱ CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H1 = -49.2kJ·mol-1,⑤反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
(1)由盖斯定律,②-①-③反应Ⅱ的△H2 =-285.8kJmol-1-(-283.0kJmol-1)-( -44.0kJ·mol-1)=41.2 kJ·mol-1。(2)在其他条件相同的情况下,将催化剂CZZA换成新型催化剂(CZZA/rGO),可以显著提高甲醇的选择性,用过渡态理论解释其原因:新型催化剂能将反应Ⅰ活化能降低更多,使反应物更容易生成甲醇;
(3)CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
n始 0.25a 0.75a
n变 0.25a×0.21×60% 0.0315a
n平 0.0315a
①在553K时,反应体系内甲醇的物质的量为 0.25a×0.21×60%=0.0315a;②随着温度的升高,C02的平衡转化率增加但甲醇的选择率降低,其原因:当温度升高时反应Ⅰ平衡逆向移动,而反应Ⅱ平衡正向移动且幅度更大,所以CO2的转化率增加,但甲醇的选择性却降低。(4)保持其它条件不变,t1时再向容器中加入一定量物质的量之比为1:3的CO2与H2混合气,t2时再次达到平衡,t2时相当于对原平衡进行加压,平衡正向移动,甲醇的体积分数增大,如图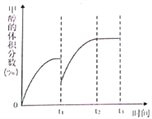 。(5)在催化剂作用下,以NaOH溶液为电解液,将甲烷气体通入石墨复合电极,电解产生甲醇。阳极甲烷氧化生成甲醇,阳极反应的电极反应式:CH4 -2e- +2OH- =CH3OH+H2O。
。(5)在催化剂作用下,以NaOH溶液为电解液,将甲烷气体通入石墨复合电极,电解产生甲醇。阳极甲烷氧化生成甲醇,阳极反应的电极反应式:CH4 -2e- +2OH- =CH3OH+H2O。

【题目】实验室常用氯化铵与氢氧化钙的固体混合物加热制取氨气,下列是实验室提供的有关装置:
气体发生装置 |
a |
b |
c |
气体收集装置 |
A |
B |
C |
上述制备氨气的化学方程为_________________________________。从上图中选择实验室制取氨气的气体发生装置________(选填编号)、气体收集装置_________(选填编号)。





