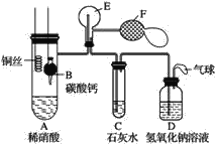
题目内容
【题目】下列说法正确的是( )
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea)kJ/mol
B.反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
C.0.1 molL-1 CH3COOH溶液加水稀释,溶液中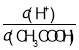 增大
增大
D.电解精炼铜时,粗铜与外接电源正极相连,电解过程中电解质溶液中的c(Cu2+)保持不变
【答案】C
【解析】
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=正反应的活化能-逆反应的活化能=(Ea-Eb)kJmol-1,故A错误;
B.如果该反应能自发进行,则△G=△H-T△S<0,该反应的△S>0,该反应在一定条件下能自发进行,则该反应不一定是放热反应,故B错误;
C.0.1 molL-1 CH3COOH溶液加水稀释,促进CH3COOH的电离,溶液中H+的微粒数增大,而CH3COOH的数目减小,因为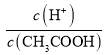 =
=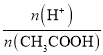 ,则溶液中
,则溶液中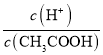 增大,故C正确;
增大,故C正确;
D.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解过程中粗铜上Cu和比Cu活泼的金属失电子被氧化,阴极上只有铜离子得电子,所以粗铜溶解的Cu质量小于阴极析出Cu的质量,则溶液中c(Cu2+)减小,故D错误;
故答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数