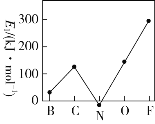
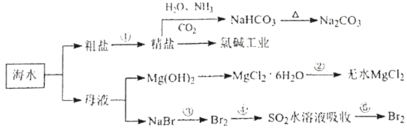
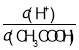��Ŀ����
����Ŀ��NA��ʾ�����ӵ���������ֵ������˵����ȷ����
��3.9g����������H2��Ӧʱ�����뷴Ӧ��̼̼˫����Ϊ0.15NA
��3.1g�����ƺ�3.9g�������ƵĻ�����к��е�����������Ϊ0.1NA
��1.8g14CH4��ˮ����(H216O)�Ļ�������к�������ĿΪNA
�ܳ�����1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����![]() ����Ŀ��ͬ
����Ŀ��ͬ
�ݳ�����4.6gNO2��N2O4���������������ԭ������Ϊ0.3NA
��1molSiO2�����к��м��Թ��ۼ���ĿΪ2NA
�߽�1molCl2ͨ������ˮ�У���Һ��HClO��Cl��ClO������֮��Ϊ2NA
������£�16.8gFe������ˮ������ȫ��Ӧת�Ƶ�����Ϊ0.8NA
A.�٢ڢܢ�B.�ڢۢݢ�C.�ڢۢޢ�D.�ۢݢߢ�
���𰸡�B
��������
�ٱ�������û��̼̼˫�����ٲ���ȷ��
�������ƺ������Ƶ�����У������������ӵĸ�������ͬ������1:2��3.1g�����ƺ�3.9g�������Ƶ����ʵ�����Ϊ0.05mol���ʻ�����к��е�����������Ϊ0.1NA������ȷ��
��14CH4��ˮ����(H216O)�ķ����ھ���10�����ӣ�14CH4��H216O��Ħ��������ͬ������1.8g14CH4��ˮ����(H216O)�Ļ����������ʵ���Ϊ1mol�����к�������ĿΪNA������ȷ��
������ͬ�¶��£��ε�ˮ��̶���Ũ���������С���ʳ�����1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����![]() ����Ŀ����ͬ���ܲ���ȷ��
����Ŀ����ͬ���ܲ���ȷ��
��4.6gNO2�����ʵ���Ϊ0.1mol����0.3NA��ԭ�ӡ�NO2��N2O4�����ʽ��ͬ������4.6gNO2��N2O4�������������ԭ��������4.6gNO2����ͬ��Ϊ0.3NA������ȷ��
��SiO2������Si����λ����4������1mol SiO2�����к��м��Թ��ۼ���ĿΪ4NA������ȷ��
��Cl2ͨ������ˮ�У�������Һ�к���Cl2��HClO��Cl-��C1O-�����ӡ��������غ��֪����1molCl2ͨ������ˮ��,��Һ��HClO��Cl-��C1O-������֮��С��2NA���߲���ȷ��
������£�Fe��ˮ������Ӧ������������������16.8gFe(��0.3mol Fe)������ˮ������ȫ��Ӧת�Ƶ�����Ϊ0.8NA������ȷ��
�����������ڢۢݢ���ȷ����ѡB��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д�����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H2
CH3OH(g)��H2O(g) ��H2
��CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H3
CO(g)��H2O(g) ��H3
��1���ش��������⣺��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/(kJ��mol��1) | 436 | 343 | 1 076 | 465 | 413 |
�ɴ˼��㦤H1��______kJ��mol��1����֪��H2����58 kJ��mol��1����H3��_______kJ��mol��1��
(2)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H����1 275.6 kJ��mol��1
��H2O(l)===H2O(g) ��H����44.0 kJ��mol��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ_________________��
��3����֪����ʱ���ױȰ����ȶ�����֪��
��P4�����ף�s��+5O2��g��===2P2O5��s����H1
��4P�����ף�s��+5O2��g��===2P2O5��s����H2
�ȽϷ�Ӧ�Ц�H�Ĵ�С����H1_______��H2�����������������=������
��4����֪��ϡ��Һ�У�H+��aq��+OH����aq��===H2O��l����H=��57.3 kJ![]() ����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������
����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������