题目内容
将装满O2和NO2混合气体的试管倒置于水槽中,充分反应后,试管中液面高度为试管高度的 ,则原混合气体中O2和NO2的体积比为
,则原混合气体中O2和NO2的体积比为
- A.1:4
- B.16:9
- C.5:4
- D.2:23
D
分析:试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,题中充分反应后,试管中液面高度为试管高度的 ,说明剩余气体为
,说明剩余气体为 ,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为
,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为 ;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮
;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮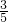 ,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.
,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.
解答:已知二氧化氮气体和氧气按4:1恰好全部溶于水生成硝酸,发生的反应为:4NO2+O2+2H2O=4HNO3,题中试管倒扣水槽中最后试管中液面高度为试管高度的 ,说明剩余气体为
,说明剩余气体为 .
.
(1)当剩余气体为氧气时,二氧化氮气体和氧气按4:1反应的混合气体体积为 ,其中二氧化氮为
,其中二氧化氮为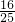 ,氧气
,氧气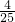 ,所以原混合气体中氧气共
,所以原混合气体中氧气共 +
+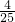 =
=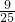 ,原混合气体中O2和NO2的体积比为
,原混合气体中O2和NO2的体积比为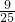 :
: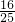 =9:16;
=9:16;
(2)如果剩余气体 为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮
为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮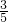 ,二氧化氮气体和氧气按4:1反应的混合气体体积为
,二氧化氮气体和氧气按4:1反应的混合气体体积为 ,其中二氧化氮体积应为
,其中二氧化氮体积应为 ×
× =
=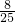 ,原混合气体中共有二氧化氮体积为
,原混合气体中共有二氧化氮体积为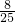 +
+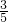 =
=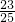 ,氧气体积为
,氧气体积为 ×
× =
=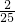 ,则原混合气体中O2和NO2的体积比为
,则原混合气体中O2和NO2的体积比为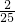 :
: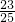 =2:23.
=2:23.
故选D.
点评:本题考查了氮氧化物的性质,及氮氧化物和氧气混合通入水中的有关计算,关键是分析剩余气体的成分.
分析:试管中O2和NO2气体按体积比1:4混合全部溶解,液体充满试管,题中充分反应后,试管中液面高度为试管高度的
 ,说明剩余气体为
,说明剩余气体为 ,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为
,可能是剩余氧气,也可以是剩余的二氧化氮气体与水反应生成的一氧化氮剩余,所以设O2体积为设混合气体总体积为5L,则如果剩余氧气时,O2和NO2按照1:4反应的混合气体为 ;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮
;如果剩余一氧化氮,按照O2和NO2气体按体积比1:4混合全部溶解,实际剩余二氧化氮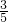 ,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.
,即可求出所有二氧化氮和氧气的体积,进而求的原混合气体中O2和NO2的体积比.解答:已知二氧化氮气体和氧气按4:1恰好全部溶于水生成硝酸,发生的反应为:4NO2+O2+2H2O=4HNO3,题中试管倒扣水槽中最后试管中液面高度为试管高度的
 ,说明剩余气体为
,说明剩余气体为 .
.(1)当剩余气体为氧气时,二氧化氮气体和氧气按4:1反应的混合气体体积为
 ,其中二氧化氮为
,其中二氧化氮为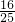 ,氧气
,氧气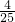 ,所以原混合气体中氧气共
,所以原混合气体中氧气共 +
+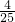 =
=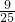 ,原混合气体中O2和NO2的体积比为
,原混合气体中O2和NO2的体积比为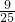 :
: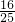 =9:16;
=9:16;(2)如果剩余气体
 为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮
为一氧化氮,根据反应3NO2+H2O=2HNO3+NO,则相当于剩余二氧化氮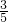 ,二氧化氮气体和氧气按4:1反应的混合气体体积为
,二氧化氮气体和氧气按4:1反应的混合气体体积为 ,其中二氧化氮体积应为
,其中二氧化氮体积应为 ×
× =
=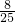 ,原混合气体中共有二氧化氮体积为
,原混合气体中共有二氧化氮体积为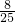 +
+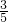 =
=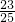 ,氧气体积为
,氧气体积为 ×
× =
=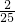 ,则原混合气体中O2和NO2的体积比为
,则原混合气体中O2和NO2的体积比为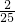 :
: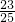 =2:23.
=2:23.故选D.
点评:本题考查了氮氧化物的性质,及氮氧化物和氧气混合通入水中的有关计算,关键是分析剩余气体的成分.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
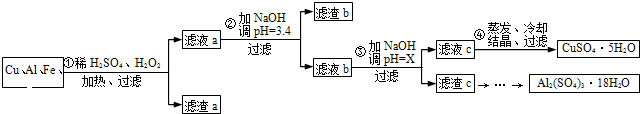
(1)过滤操作中用到的玻璃仪器有______.
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是______.
(3)滤渣a的主要成分是______.
(4)步骤③中X的取值范围是______.
(5)假设制得的CuSO4?5H2O中只含Na2SO4杂质,若用该样品进行“硫酸铜晶体结晶水含量的测定”实验,测得结晶水含量______(填“偏低”、“偏高”或“无影响”).乙同学取1.280g该样品,加热至恒重称得质量变为0.830g,则此样品的纯度为______.(用小数表示,保留三位有效数字)
某溶液含有下表离子中的几种(不考虑水的电离及离子的水解).溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种.
| 阳离子 | Ba2+ NH4+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- SO32- SO42- |
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀.过滤,得滤液B.
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成.过滤,得滤液C,此过程中沉淀的量不减少.
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成.
根据上述实验回答下列问题.
(1)原溶液中一定不存在的阴离子是______.
(2)写出③总的离子方程式______.
(3)若原溶液由一种盐溶解于水制得,则该盐的化学式为______.
(4)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的化学式为______,其物质的量之比为______.
ⅰ、M溶液中各离子浓度由大到小的顺序为______.
ⅱ、实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是______.



 mol
mol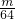 mol
mol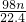 mol
mol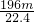 mol
mol 下列关于分散系的叙述不正确的是
下列关于分散系的叙述不正确的是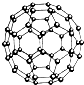 N60结构如图,28g N60单质中含有的N-N键个数为NA
N60结构如图,28g N60单质中含有的N-N键个数为NA