题目内容
设NA表示阿伏加德罗常数的数值,下列说法中不正确的是
- A.一定量的Fe与1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
- B.160 g CuO 加热到1273K时完全分解,若转移2NA个电子,则反应方程式为:2CuO?2Cu+O2↑
- C.
 N60结构如图,28g N60单质中含有的N-N键个数为NA
N60结构如图,28g N60单质中含有的N-N键个数为NA - D.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA
BC
分析:A、硝酸与铁反应,硝酸起氧化剂与还原剂作用.
B、160gCuO的物质的量为2mol,转移2NA个电子,即转移电子的物质的量为2mol,所以铜元素的化合价降低1价,即生成氧化亚铜与氧气.
C、28g N60单质的物质的量为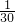 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90.
=90.
D、CaCO3与Mg3N2的摩尔质量都是100g/mol,平均摩尔质量为100g/mol,物质的量为0.006mol,每摩尔CaCO3与Mg3N2的含有质子都是50mol,据此计算.
解答:A、硝酸与铁反应,硝酸起氧化剂与还原剂作用,参加反应的HNO31mol,还原的硝酸小于1mol,所以被还原的氮原子数小于NA,故A正确;
B、160gCuO的物质的量为 =2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;
=2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;
C、28g N60单质的物质的量为 =
=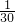 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90,含有有的N-N键个数为
=90,含有有的N-N键个数为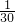 mol×90×NAmol-1=3NA,故C错误;
mol×90×NAmol-1=3NA,故C错误;
D、CaCO3与Mg3N2的摩尔质量都是100g/mol,平均摩尔质量为100g/mol,0.6gCaCO3与Mg3N2的混合物的物质的量为0.006mol,每摩尔CaCO3与Mg3N2的含有质子都是50mol,所以含有的质子数为0.006mol×50×NAmol-1=0.3NA,故D正确.
故选:BC.
点评:考查常用化学计量计算、氧化还原反应、晶体结构等,难度中等,注意C中利用均摊法计算化学键.
分析:A、硝酸与铁反应,硝酸起氧化剂与还原剂作用.
B、160gCuO的物质的量为2mol,转移2NA个电子,即转移电子的物质的量为2mol,所以铜元素的化合价降低1价,即生成氧化亚铜与氧气.
C、28g N60单质的物质的量为
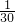 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90.
=90.D、CaCO3与Mg3N2的摩尔质量都是100g/mol,平均摩尔质量为100g/mol,物质的量为0.006mol,每摩尔CaCO3与Mg3N2的含有质子都是50mol,据此计算.
解答:A、硝酸与铁反应,硝酸起氧化剂与还原剂作用,参加反应的HNO31mol,还原的硝酸小于1mol,所以被还原的氮原子数小于NA,故A正确;
B、160gCuO的物质的量为
 =2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;
=2mol,转移2NA个电子,即转移电子的物质的量为2mol,根据电子转移守恒可知,铜在还原产物的化合价为+1价,即生成氧化亚铜与氧气,反应方程式为4CuO=2Cu2O+O2↑,故B错误;C、28g N60单质的物质的量为
 =
=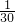 mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供
mol,由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供 个N-N键,所以分子共有N-N数目为60×3×
个N-N键,所以分子共有N-N数目为60×3× =90,含有有的N-N键个数为
=90,含有有的N-N键个数为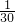 mol×90×NAmol-1=3NA,故C错误;
mol×90×NAmol-1=3NA,故C错误;D、CaCO3与Mg3N2的摩尔质量都是100g/mol,平均摩尔质量为100g/mol,0.6gCaCO3与Mg3N2的混合物的物质的量为0.006mol,每摩尔CaCO3与Mg3N2的含有质子都是50mol,所以含有的质子数为0.006mol×50×NAmol-1=0.3NA,故D正确.
故选:BC.
点评:考查常用化学计量计算、氧化还原反应、晶体结构等,难度中等,注意C中利用均摊法计算化学键.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目