题目内容
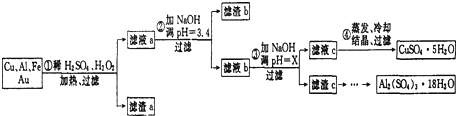
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |

(1)过滤操作中用到的玻璃仪器有______.
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是______.
(3)滤渣a的主要成分是______.
(4)步骤③中X的取值范围是______.
(5)假设制得的CuSO4?5H2O中只含Na2SO4杂质,若用该样品进行“硫酸铜晶体结晶水含量的测定”实验,测得结晶水含量______(填“偏低”、“偏高”或“无影响”).乙同学取1.280g该样品,加热至恒重称得质量变为0.830g,则此样品的纯度为______.(用小数表示,保留三位有效数字)
解:(1)过滤是化学实验中经常用到的实验操作.过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
故答案为:烧杯、漏斗、玻璃棒;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是:Cu+H2O2+2H+→Cu2++2H2O;
故答案为:Cu+H2O2+2H+═Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中;
故答案为:Au;
(4)加入氢氧化钠溶液调节PH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀PH=4,沉淀完全PH=5.2,氢氧化铜开始沉淀PH=5.4,所以选择的PH范围是:5.2≤X<5.4;
故答案为:5.2≤X<5.4;
(5)含有硫酸钠杂质,利用质量差求出的结晶水的质量减少,结晶水含量偏低;
结晶水的质量是:1.280g-0.830g=0.45g,n(H2O)=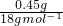 =0.025mol,n(CuSO4)=
=0.025mol,n(CuSO4)=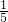 ×0.025mol=0.005mol,
×0.025mol=0.005mol,
样品的纯度为: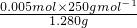 =0.977;
=0.977;
故答案为:0.977.
分析:(1)过滤操作用到的仪器有烧杯、漏斗、玻璃棒;
(2)铜被双氧水氧化成铜离子,Cu+H2O2+2H+→Cu2++2H2O;
(3)Cu、Al及少量Fe、Au等金属的混合物,其中铜、铝、铁都发生反应而溶解,Au化学性质稳定,成为滤渣a的主要成分;
(4)滤渣c是氢氧化铝,根据部分阳离子以氢氧化物形式沉淀时溶液的pH表,选择使氢氧化铝沉淀完全且氢氧化铜不沉淀的PH;
(5)由于含有硫酸钠杂质,加热后质量减少数值偏小,结晶水含量偏低;根据质量差计算出结晶水的质量,再计算出样品中含有的硫酸铜晶体的质量和纯度.
点评:本题考查金属混合物的分离和提纯,关键是提取题中的信息,根据所学知识完成,本题难度中等.
故答案为:烧杯、漏斗、玻璃棒;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是:Cu+H2O2+2H+→Cu2++2H2O;
故答案为:Cu+H2O2+2H+═Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中;
故答案为:Au;
(4)加入氢氧化钠溶液调节PH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀PH=4,沉淀完全PH=5.2,氢氧化铜开始沉淀PH=5.4,所以选择的PH范围是:5.2≤X<5.4;
故答案为:5.2≤X<5.4;
(5)含有硫酸钠杂质,利用质量差求出的结晶水的质量减少,结晶水含量偏低;
结晶水的质量是:1.280g-0.830g=0.45g,n(H2O)=
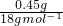 =0.025mol,n(CuSO4)=
=0.025mol,n(CuSO4)=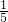 ×0.025mol=0.005mol,
×0.025mol=0.005mol,样品的纯度为:
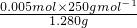 =0.977;
=0.977;故答案为:0.977.
分析:(1)过滤操作用到的仪器有烧杯、漏斗、玻璃棒;
(2)铜被双氧水氧化成铜离子,Cu+H2O2+2H+→Cu2++2H2O;
(3)Cu、Al及少量Fe、Au等金属的混合物,其中铜、铝、铁都发生反应而溶解,Au化学性质稳定,成为滤渣a的主要成分;
(4)滤渣c是氢氧化铝,根据部分阳离子以氢氧化物形式沉淀时溶液的pH表,选择使氢氧化铝沉淀完全且氢氧化铜不沉淀的PH;
(5)由于含有硫酸钠杂质,加热后质量减少数值偏小,结晶水含量偏低;根据质量差计算出结晶水的质量,再计算出样品中含有的硫酸铜晶体的质量和纯度.
点评:本题考查金属混合物的分离和提纯,关键是提取题中的信息,根据所学知识完成,本题难度中等.

练习册系列答案
相关题目