题目内容
m g铜与足量浓H2SO4共热时完全反应,在标准状况下生成n L气体,则被还原的H2SO4的量是
- A.
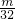 mol
mol - B.
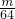 mol
mol - C.
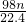 mol
mol - D.
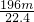 mol
mol
B
分析:根据铜与足量浓H2SO4共热反应时,浓硫酸的作用有:酸性和强氧化性.
解答:因铜与浓硫酸反应:Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,浓硫酸的作用有:酸性和强氧化性,
CuSO4+2H2O+SO2↑,浓硫酸的作用有:酸性和强氧化性,
被还原的H2SO4的物质的量=铜的物质的量=SO2气体的物质的量,
由Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑可知,被还原的H2SO4的物质的量等于二氧化硫的物质的量,即为
CuSO4+2H2O+SO2↑可知,被还原的H2SO4的物质的量等于二氧化硫的物质的量,即为 mol,
mol,
其质量为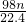 g,
g,
故答案为:B.
点评:本题主要考查了浓硫酸在反应中的作用,并要求掌握被还原的H2SO4的量与其他物质的量之间的关系.
分析:根据铜与足量浓H2SO4共热反应时,浓硫酸的作用有:酸性和强氧化性.
解答:因铜与浓硫酸反应:Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑,浓硫酸的作用有:酸性和强氧化性,
CuSO4+2H2O+SO2↑,浓硫酸的作用有:酸性和强氧化性,被还原的H2SO4的物质的量=铜的物质的量=SO2气体的物质的量,
由Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑可知,被还原的H2SO4的物质的量等于二氧化硫的物质的量,即为
CuSO4+2H2O+SO2↑可知,被还原的H2SO4的物质的量等于二氧化硫的物质的量,即为 mol,
mol,其质量为
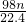 g,
g,故答案为:B.
点评:本题主要考查了浓硫酸在反应中的作用,并要求掌握被还原的H2SO4的量与其他物质的量之间的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
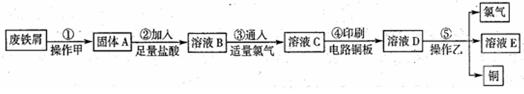
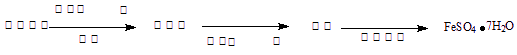 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是 
 (3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是
(3)丙同学为测试一铁片中铁元素的含量,在实验室中用m g铁片完全溶解于过量稀硫酸中,准确测定出反应生成氢气的体积为V mL (已折算成标准状况),则该铁片中铁的质量分数为(用含m、V的代数式表示) 。若排除实验仪器和操作的影响因素,试对上述方案测定结果的准确性做出判断和分析:方案 (填“准确”“不准确”“不一定准确”),理由是