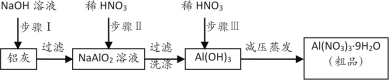
题目内容
【题目】某化工厂排放的污水中含有FeSO4、CuSO4两种物质。甲、乙、丙三位学生分别设计了从该污水中回收纯净金属铜的方案(如图所示)。
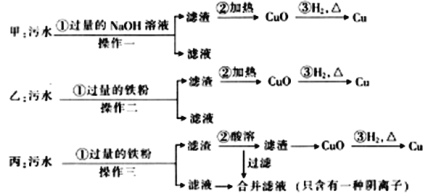
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
甲___,乙___,丙___。(填“能”或“不能”)
(2)在丙同学进行的“酸溶”操作中,加入的酸是___(填“稀盐酸”或“稀硫酸“)。合并的滤液中的主要溶质是___。
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为___。
(4)操作一、二、三的名称是___,该操作中需使用的玻璃仪器有___。
【答案】不能 不能 能 稀硫酸 FeSO4 Fe+CuSO4=FeSO4+Cu 过滤 漏斗、烧杯、玻璃棒
【解析】
(1)甲中加入过量NaOH,生成Fe(OH)2、Cu(OH)2沉淀,过滤后所得滤渣的成分为Fe(OH)2、Cu(OH)2,加热后生成Fe2O3、CuO,用H2还原可得Fe、Cu的混合物。
乙中,加入过量铁粉,滤渣为Fe、Cu的混合物,加热后生成Fe3O4、CuO,用H2还原得到Fe、Cu的混合物。
丙中,加入过量铁粉,滤渣为Fe、Cu的混合物,加稀硫酸溶解Fe,生成FeSO4,滤渣为Cu,加热生成CuO,H2还原得到Cu。
甲不能。答案为:不能
乙不能。答案为:不能
丙能。答案为:能
(2)在丙同学进行的“酸溶”操作中,因为原来的盐都是硫酸盐,所以加入的酸是稀硫酸。答案为:稀硫酸
合并的滤液中的主要溶质是FeSO4。答案为:FeSO4
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为
Fe+CuSO4=FeSO4+Cu。答案为:Fe+CuSO4=FeSO4+Cu
(4)操作一、二、三都是分离固、液混合物,所以名称是过滤。答案为:过滤
该操作中需使用的玻璃仪器有漏斗、烧杯、玻璃棒。答案为:漏斗、烧杯、玻璃棒

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】二氯化二硫(S2C12)用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体。S2Cl2是一种有毒并有恶臭气味的浅黄色液体,在300℃以上完全分解,其蒸汽遇水分解,易溶解硫磺;将适量氯气通入熔融的硫磺而得,过量的Cl2会将S2Cl2进一步氧化得到SCl2。以下是对S2Cl2的制备及研究,请回答下列问题:
Ⅰ.S2Cl2的制备
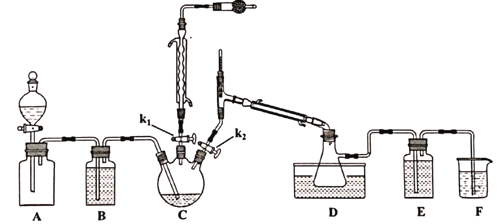
已知,各物质的熔沸点如下:
物质 | S | S2Cl2 | SCl2 |
沸点/℃ | 445 | 138 | 59 |
熔点/℃ | 113 | -76 | -122 |
制备的流程为:
①A装置集气瓶中充满Cl2,打开A装置中的分液漏斗,打开k1、k2,一段时间后关闭k2。
②接通冷凝水,将C加热至135~140℃。
③一段时间后关闭k1,同时打开k2,最后在D中收集到浅黄色液体。
(1)实验室制取氯气的反应方程式_________________________________。
(2)A装置分液漏斗中盛装的液体是___________。
A.CCl4 B.饱和NaHCO3溶液 C饱和NaCl溶液
(3)滴加过程要缓慢,原因是____________________________________________。
(4)D装置中水浴温度应控制为___________,原因是_______________________________。
Ⅱ.S2Cl2纯度的测定
已知:S2Cl2遇水分解的化学方程式:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,取agⅡ中黄色液体于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的C0 mol/L的AgNO3溶液V0mL。再向锥形瓶中加入硝基苯,将生成的沉淀覆盖。加入适量Fe(NO3)3作指示剂,用C1 mol/L NaSCN溶液滴定至终点,消耗 NaSCN溶液V1mL(滴定过程发生反应:Ag++SCN-= AgSCN↓)
(5)滴定终点的现象为_________________________________。
(6)S2Cl2的纯度为___________(写出表达式);若滴定过程中未加硝基苯,则所得纯度___________。(填“偏大”、“偏小”、“无影响”)
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
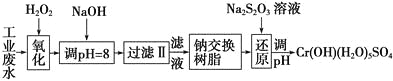
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2B.HNO3C.FeCl3D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O![]() 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O![]() 的废水:
的废水:
该法用Fe作电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O![]() 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5mol·L-1。