题目内容
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
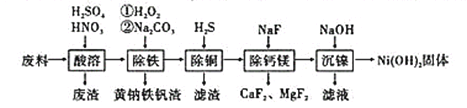
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
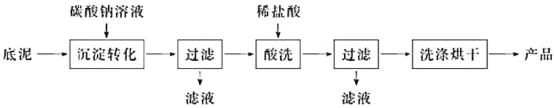
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
【答案】当滴入最后一滴NaOH标准液时,溶液由无色变为粉红色,且30s不褪色 0.0108 加入碳酸钠溶液后,溶液中的碳酸根离子与钙离子结合,转化为溶解度更小的碳酸钙沉淀,使硫酸钙的沉淀溶解平衡向溶解方向移动 氟化钙微溶于稀盐酸,在酸洗过程中有部分损失
【解析】
(1)待测液用酚酞作指示剂,滴加的标准液为NaOH,终点时,再滴入时则碱过量,溶液显浅红色;根据c1×V1=c2×V2计算;
(2)①硫酸钙微溶于水,碳酸钙难溶于水,加入碳酸钠溶液后,破环硫酸钙的溶解平衡;
②已知氟化钙微溶于无机酸,酸洗时少量溶解,质量减少。
(1)滴定终点的判断方法为:当滴入最后一滴NaOH标准液时,溶液由无色变为粉红色,且30s不褪色;根据c1×V1=c2×V2,c(HF)=0.0100mol/L×27mL/25mL=0.0108mol/L;
(2)①硫酸钙微溶于水,碳酸钙难溶于水,加入碳酸钠溶液后,溶液中的碳酸根离子与钙离子结合,转化为溶解度更小的碳酸钙沉淀,使硫酸钙的沉淀溶解平衡向溶解方向移动,最终转变为碳酸钙;
②已知氟化钙微溶于无机酸,在用盐酸洗涤时,少量溶解,因此质量减少。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案