题目内容
对于工业合成氨反应:N2+3H2 2NH3,下列说法错误的是
2NH3,下列说法错误的是
 2NH3,下列说法错误的是
2NH3,下列说法错误的是| A.使用合适的催化剂可以加快反应速率 |
| B.升高温度可以加快反应速率 |
| C.增大N2浓度可以使H2转化率达到100% |
| D.增大N2浓度可以加快反应速率 |
C
分析:从影响化学反应速率的因素判断反应速率的变化,该反应为可逆反应,反应物不可能完全转化.
解:A.催化剂可降低反应物的活化能,提高活化分子百分数,提高反应速率,故A正确;
B.升高温度可提高活化分子的百分数,提高反应速率,故B正确;
C.该反应为可逆反应,反应物不可能完全转化,故C错误;
D.增大N2浓度,单位体积活化分子的数目增大,反应速率增大,故D正确.
故选C.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
 Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为( )
Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为( ) 3C(g)+4D(g)体系中A的浓度
3C(g)+4D(g)体系中A的浓度 的反应速率增大的是
的反应速率增大的是 CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)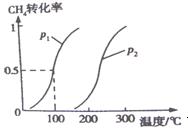
 式为K= ,100℃,压强为p1时平衡常数的值是 。
式为K= ,100℃,压强为p1时平衡常数的值是 。
 剧烈______________
剧烈______________ C2的化学反应速率。甲测得v(A2)=0.5mol·(L·min)-1,乙测得v(B2)="1.5" mol·(L·min)-1,则两个学生测定的结果
C2的化学反应速率。甲测得v(A2)=0.5mol·(L·min)-1,乙测得v(B2)="1.5" mol·(L·min)-1,则两个学生测定的结果