题目内容
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
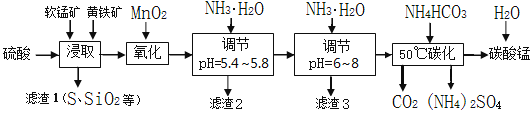
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
【答案】AB MnO2+FeS2+2H2SO4![]() MnSO4+FeSO4+2S+2H2O使Fe3+、Al3+完全沉淀Cu(OH)22HCO3+Mn2+
MnSO4+FeSO4+2S+2H2O使Fe3+、Al3+完全沉淀Cu(OH)22HCO3+Mn2+![]() MnCO3↓+H2O+CO2↑
MnCO3↓+H2O+CO2↑
【解析】
由流程图可知,浸取时MnO2与FeS2在H2SO4作用下,反应生成MnSO4、FeSO4、S和H2O;氧化时,加入的MnO2在酸性条件下将Fe2+氧化为Fe3+;由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,pH为6~8时,Cu2+完全沉淀;50℃碳化过程为硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳。
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有适当升高温度、搅拌、加入足量硫酸等,加入纯碱会减小硫酸浓度,对无气体参加的反应,加压对化学反应速率无影响,故选AB;(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,说明溶液中无Fe3+,即FeS2反应时生成了Fe2+和S,MnO2转化为Mn2+,反应的化学方程式为MnO2+FeS2+2H2SO4![]() MnSO4+FeSO4+2S+2H2O;(3)由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,则调节pH为5.4~5.8的目的是将Fe3+、Al3+完全沉淀除去;(4)pH为6~8时,Cu2+完全沉淀,则滤渣3的主要成分为Cu(OH)2;(5)50℃碳化得到碳酸锰,碳化过程中硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳,反应的化学方程式为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑,则离子方程式为2HCO3+Mn2+
MnSO4+FeSO4+2S+2H2O;(3)由表给完全沉淀pH可知,pH为5.4~5.8时,Fe3+、Al3+完全沉淀,则调节pH为5.4~5.8的目的是将Fe3+、Al3+完全沉淀除去;(4)pH为6~8时,Cu2+完全沉淀,则滤渣3的主要成分为Cu(OH)2;(5)50℃碳化得到碳酸锰,碳化过程中硫酸锰和碳酸氢铵反应生成碳酸锰、硫酸铵、水和二氧化碳,反应的化学方程式为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑,则离子方程式为2HCO3+Mn2+![]() MnCO3↓+H2O+CO2↑。
MnCO3↓+H2O+CO2↑。


