题目内容
19.短周期主族元素A、B、C、D、E,原子序数由A到E依次增大.A元素的原子最外层电子数是内层电子数的两倍,且与C元素同主族.B是原子半径最大的短周期主族元素,其单质在空气中燃烧产物的颜色与D单质的颜色相同,都是淡黄色.试根据以上叙述回答:(1)A的原子结构示意图为
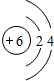 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.(2)B元素的最高价氧化物的水化物与C元素的最高价氧化物反应的离子方程式为SiO2+2OH-═SiO32-+H2O.
(3)能说明D的非金属性比E的非金属性弱(填“强”或“弱”)的事实是:酸性:HClO4>H2SO4(或稳定性:HCl>H2S)等 (举一例,其中涉及的元素和物质用元素符号或分子式表示.)
分析 短周期主族元素A、B、C、D、E,原子序数由A到E依次增大.B是原子半径最大的短周期主族元素,其单质在空气中燃烧产物的颜色与D单质的颜色相同,都是淡黄色,则B为Na、D为S;E的原子序数大于硫,故E为Cl;A元素的原子最外层电子数是内层电子数的两倍,最外层电子数为4,原子序数小于Na,处于第二周期,故A为C元素,A与C元素同主族,则C为Si,据此解答.
解答 解:短周期主族元素A、B、C、D、E,原子序数由A到E依次增大.B是原子半径最大的短周期主族元素,其单质在空气中燃烧产物的颜色与D单质的颜色相同,都是淡黄色,则B为Na、D为S;E的原子序数大于硫,故E为Cl;A元素的原子最外层电子数是内层电子数的两倍,最外层电子数为4,原子序数小于Na,处于第二周期,故A为C元素,A与C元素同主族,则C为Si.
(1)A为碳元素,原子结构示意图为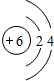 ,C为Si,在周期表中的位置为:第三周期ⅣA族,E的元素名称为:氯,
,C为Si,在周期表中的位置为:第三周期ⅣA族,E的元素名称为:氯,
故答案为: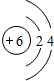 ;第三周期ⅣA族;氯;
;第三周期ⅣA族;氯;
(2)B元素的最高价氧化物的水化物为NaOH,C元素的最高价氧化物为SiO2,二者反应生成硅酸钠与水,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(3)S的非金属性比Cl的非金属性弱,具体的事实是:酸性:HClO4>H2SO4(或稳定性:HCl>H2S)等,
故答案为:弱;酸性:HClO4>H2SO4(或稳定性:HCl>H2S)等.
点评 本题考查结构性质位置关系应用,难度不大,明确元素种类是解题关键,注意掌握金属性、非金属性强弱比较实验事实,有利于基础知识的巩固.

练习册系列答案
相关题目
9.已知1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是( )
| A. | 若P>K,则还原性cZP-<dWk- | |
| B. | 若m>n,则碱性 X(OH)m>Y(OH)n | |
| C. | 若半径aXm+>bYn+,则a<b | |
| D. | 若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
10.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )


| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和浓氢溴酸共热时,键②和③断裂 | |
| D. | .在铜催化下和氧气反应时,键①和③断裂 |
7.下列说法正确的是( )
| A. | 二氧化硅可以用来制造光导纤维 | |
| B. | 工艺师利用盐酸刻蚀石英制作艺术品 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 粗硅制单晶硅不涉及氧化还原反应 |
14.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
4.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
①微粒半径:S2->Cl>S>F
②氢化物的稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④碱性:KOH>NaOH>Mg(OH)2
⑤酸性:H2SO4>HClO4>H2SeO4
⑥失电子能力:Na>Mg>Al.
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
11.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
8.假设x是ⅡB族中元素的原子序数,那么原子序数为x+1的元素是( )
| A. | ⅠB族 | B. | ⅢB族 | C. | ⅢA族 | D. | ⅡA族 |
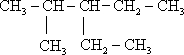 ;
;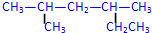 2,4-二甲基己烷
2,4-二甲基己烷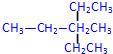 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O.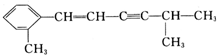 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.