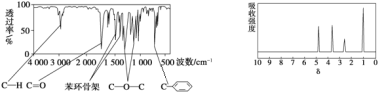
��Ŀ����
����Ŀ������Ԫ�صĻ�����㷺��������Ȼ���У����������ﹲͬ������ʯ�������(�۵�1410��)��;�㷺����ȡ���ᴿ�����ж��֡�
(1)���ֿ�ʼ�ͽ����ζ����ܷ�����Ӧ��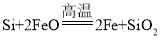 ����Ŀ����________��
����Ŀ����________��
A.�õ�����Ʒ������ˮ�� B.��ȡSiO2�������ֵ�Ӳ��
C.��ȥ�����й����Si���� D.������FeO����ֹ�ֱ��
(2)һ���ɴֹ��ƴ���������£�![]() ��������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_______�������Ƶ�±����(NaX)���±����(SiX4)����������ȷ������_________��
��������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_______�������Ƶ�±����(NaX)���±����(SiX4)����������ȷ������_________��
A.NaX��ˮ�� B.SiX4�ǹ��ۻ�����
C.NaX���۵�һ�����SiX4 D.SiF4�������ɹ��ۼ��γɵĿռ���״�ṹ
(3)�ֹ辭ϵ�з�Ӧ�����ɹ���(SiH4)������ֽ�Ҳ�������ɸߴ��衣��������ȶ������ڼ��飬 ����SiԪ�صķǽ���������CԪ�أ���ԭ�ӽṹ������ԭ��_______��
(4)���⣬�����Խ��ֹ�ת�����������(SiHCl3)��ͨ����Ӧ��SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)�Ƶøߴ��衣��ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ������__________��������ĸ��ţ���
Si(s)+3HCl(g)�Ƶøߴ��衣��ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ������__________��������ĸ��ţ���
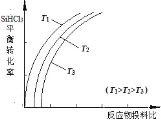
a.�÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.�������ʾ��Ͷ�ϱ�Ӧ����![]()
c.ʵ��������Ϊ���SiHCl3�������ʣ����ʵ�����ѹǿ
(5)��Ԫ������������Ӧ��ˮ������H2SiO3�������£�0.1mol/L�Ĺ�������Һ��0.1mol/L��̼������Һ�����Ը�ǿ����_______����ԭ����_______��
��֪��H2SiO3��Ki1=2.0��10-10��Ki2=1.0��10-12��H2CO3��Ki1=4.3��10-7��Ki2=5.6��10-11��
���𰸡�CD 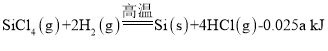 BC C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� a��c ������ �����Ki2С��̼���Ki2�������Ƹ���ˮ��
BC C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� a��c ������ �����Ki2С��̼���Ki2�������Ƹ���ˮ��
��������
(1)�������ֵ�Ҫ��������еĺ�̼����ȥ���涨��Χ����ʹ����Ԫ�صĺ������ٻ����ӵ��涨��Χ�Ĺ��̣���˵���Ƕ�������̼��ȥ���ס������̺����Ĺ��̣���ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д�������Ԫ�أ����к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ�
(2)ÿ����1.12kg����������a kJ������������1mol�������յ�����Ϊ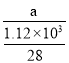 =0.025a kJ���ݴ�д����Ӧ�Ȼ�ѧ����ʽ��
=0.025a kJ���ݴ�д����Ӧ�Ȼ�ѧ����ʽ��
A.ǿ������β�ˮ�⣻
B.���±����(SiX4)���ɷǽ���Ԫ��ԭ�Ӽ�ͨ�����õ��Ӷ��γɵĻ����
C.���Ӿ�����۵���ڷ��Ӿ�����۵㣻
D.SiF4�������ڷ��Ӿ��壻
(3)����ķֽ��¶�Զ���ڼ����ԭ��Ϊ��C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si����
SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��飻
(4)a.��Ϊ�����¶ȵ����ߣ�SiHCl3��ת��������ƽ�����ƣ���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.����һ�ַ�Ӧ���Ũ�ȣ������������Ӧ���ת���ʣ���������ת���ʷ������ͣ��ʺ������ʾ��Ͷ�ϱ�Ӧ����![]() ��
��
c.����ѹǿƽ��������ϵ����С�����ƶ���
(5)��������ˮ�������Խ��Խˮ�������
(1)���ֵ�Ҫ��������еĺ�̼����ȥ���涨��Χ����ʹ����Ԫ�صĺ������ٻ����ӵ��涨��Χ�Ĺ��̣���˵���Ƕ�������̼��ȥ���ס������̺����Ĺ��̣���һ���̻�������һ���������̣����ò�ͬ��Դ����(������е�����������������ʯ�е���)��������ˮ�е�̼���衢�̵�Ԫ�أ���ѧ��Ӧ��Ҫ��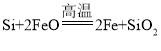 ��
�� ����ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д������������к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ������ֵ����α���������������������������������ȣ����Գ�ȥ��Һ�ж��������
����ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д������������к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ������ֵ����α���������������������������������ȣ����Գ�ȥ��Һ�ж�������� ��
��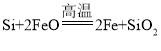 ��
��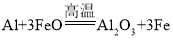 ��
��
�ʺ���ѡ����CD��
(2)�������֪��ÿ����1.12kg����������akJ������������1mol�������յ�����Ϊ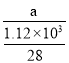 =0.025a kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��
=0.025a kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��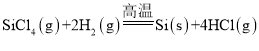 ��H= -0.025a kJ/mol��
��H= -0.025a kJ/mol��
A.�Ƶ�ǿ���β�ˮ�⣬NaX(NaF����)����ˮ�⣬A����
B.���±���SiX4�����ɷǽ���Ԫ��ԭ�Ӽ�ͨ�����õ��Ӷ��γɵĻ�����ǹ��ۻ����B��ȷ��
C.�Ƶ�±����(NaX)Ϊ���ӻ������������Ӿ��壬���±����(SiX4)Ϊ���ۻ��������ڷ��Ӿ��壬���Ӿ�����۵���ڷ��Ӿ�����۵㣬��NaX���۵�һ�����SiX4��C��ȷ��
D.SiF4�������ɷ��Ӽ���������϶��ɣ�D����
�ʺ���ѡ����BC��
(3)C��Si������������ͬ(������ͬ����Ԫ����)��Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��飬�ʹ���ķֽ��¶�Զ���ڼ��飻
(4)a.��Ϊ�����¶ȵ����ߣ�SiHCl3��ת��������˵�������¶ȣ���ѧƽ�������ƶ�����÷�Ӧ��ƽ�ⳣ�����¶����߶�����a��ȷ��
b.����һ�ַ�Ӧ���Ũ�ȣ������������Ӧ���ת���ʣ���������ת���ʷ������ͣ��ʺ������ʾ��Ͷ�ϱ�Ӧ����![]() ��b����
��b����
c.SiHCl3(g)+H2(g)Si(s)+3HCl(g)������Ӧ����Ϊ����ϵ����������ѹǿƽ��������ϵ�����������Ӧ�����ƶ����������SiHCl3�������ʣ�c��ȷ��
�ʺ���ѡ����a��c��
(5)�����������ݿ�֪�������Ki2С��̼���Ki2��������Խ��Խˮ������֪�����Ƹ���ˮ�⡣

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д�����Ŀ����һ����ͭ������ĩƽ���ֳ����ȷݣ��ֱ���뵽ͬŨ�ȡ���ͬ�����ϡ�����У���ַ�Ӧ���ռ���NO����������ʣ������������� ���跴Ӧǰ����Һ��������䣬��������ѻ���Ϊ��״��ʱ���������
ʵ����� | ϡ��������/mL | ʣ����������/g | NO�����/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
����˵����ȷ���ǣ�������
A. ����V=7.84 L
B. ԭ������ĩ������Ϊ25.6 g
C. ԭ������δ������ͭ�����ʵ���֮��Ϊ2��3
D. ʵ��3������Һ����������ʵ���Ũ��Ϊ0.875 molL��1
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��ϡ��������⣩������˵����ȷ����______��
a��ԭ�Ӱ뾶�����Ӱ뾶����С
b�������Լ������ǽ�������ǿ
c�����ʵ��۵㽵��
d���������Ӧ��ˮ������Լ�����������ǿ
ԭ�������������������������ͬ��Ԫ������Ϊ_____�������������ļ���������____��
(2)��֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ����_____������ʱ�����Al2O3�������AlCl3��ԭ����_____��
(3)����裨�۵�1410���������õİ뵼����ϡ��ɴֹ��ƴ���������£�
Si���֣�![]() SiCl4
SiCl4![]() SiCl4������
SiCl4������![]() Si������
Si������
д��SiCl4�ĵ���ʽ��_____��
(4)�������岻����Ũ����������P2O5�������_____��
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____��