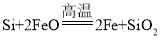题目内容
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____,氧化性最弱的简单阳离子是____。
(2)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____;制铝时,电解Al2O3而不电解AlCl3的原因是_____。
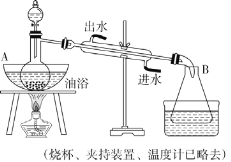
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____。
【答案】b 氩 Na+ MgO熔点高,耗能大 AlCl3是共价化合物,熔融状态不导电 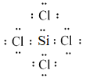 b 4KClO3
b 4KClO3![]() KCl+3KClO4
KCl+3KClO4
【解析】
第三周期元素包括Na、Mg、Al、Si、P、S、Cl、Ar。根据同周期元素性质的递变性和原子结构解答(1);根据表格给出的信息,结合实际生产解答(2);SiCl4和CCl4结构相似,据此可以解答(3);浓硫酸不能干燥碱性和还原性气体,P2O5不能干燥碱性气体;根据氧化还原反应规律和氯元素的化合价书写KClO3分解的化学方程式。
(1) a.同周期元素从左到右,核电荷数逐渐增多,对核外电子的束缚力逐渐增强,所以原子半径逐渐减小;阳离子Na+、Mg2+、Al3+半径逐渐减小,阴离子半径也逐渐减小,但由于阴离子比阳离子多一个电子层,所以阳离子半径小于阴离子半径,故a错误;
b.同周期元素从左到右,核电荷数逐渐增多,对核外电子的束缚力逐渐增强,所以金属性减弱,非金属性增强,故b正确;
c.Na、Mg、Al三种金属单质的熔点逐渐升高,Si、P、S、Cl对应的四种单质的熔点逐渐降低,故c错误;
d.同周期元素从左到右,最高价氧化物对应的水化物碱性减弱,酸性增强,非最高价氧化物对应水化物的递变不完全符合此规律,如H2SO3的酸性强于HClO,故d错误;
故选b。
第三周期原子的次外层电子数是8,原子最外层电子数与次外层电子数相同,则为Ar,元素名称为氩。Na单质的还原性最强,则Na+的氧化性最弱。
(2) MgCl2 和MgO都是离子化合物,熔融状态下都能导电,但MgO熔点高,加热到熔融状态需要消耗更多的能量,所以工业制镁时,电解MgCl2而不电解MgO;制铝时,只能电解熔融的Al2O3,因为AlCl3是共价化合物,熔融状态时不导电。
(3)SiCl4和CCl4结构相似,Si原子和每个Cl原子都共用一对电子,在SiCl4分子中每个原子都达到了8电子稳定结构,电子式为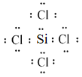 。
。
(4)NH3是碱性气体,既不能用浓硫酸干燥,也不能用P2O5干燥;HI具有还原性,会被浓硫酸氧化,不能用浓硫酸干燥,但由于HI是酸性气体,可以用P2O5干燥;SO2虽然有还原性,但由于和浓硫酸里的硫价态相邻,所以不能被浓硫酸氧化,可以用浓硫酸干燥,也可以用P2O5干燥;CO2是酸性气体,既可以用浓硫酸干燥,也可以用P2O5干燥,故选b。
(5)KClO3 400℃时分解只生成两种盐,其中一种是无氧酸盐为KCl,氯元素的化合价从+5降低到-1价,则生成的另一种盐中氯的化合价应该升高到+7价,而且盐中阴阳离子个数比为1:1,所以是KClO4,根据电子守恒配平反应方程式:4KClO3![]() KCl+3KClO4。
KCl+3KClO4。